Kwantummechanisch model van het atoom

- 1847
- 580
- Pete Heaney V
Wat is het kwantummechanische model van het atoom?
Hij Kwantummechanisch model van het atoom Het veronderstelt dat dit wordt gevormd door een centrale kern gevormd door protonen en neutronen. De elektronen, van negatieve belasting, wikkelen de kern in diffuse gebieden die bekend staan als orbitalen.
De vorm en uitbreiding van elektronische orbitalen wordt bepaald door verschillende magnitudes: de kernpotentiaal en gekwantiseerde niveaus van energie en hoekmomentum van elektronen.
 Figuur 1. Model van een heliumatoom volgens de kwantummechanica. Het bestaat uit de waarschijnlijkheid wolk van de twee heliumelektronen die 100 duizend keer kleiner een positieve kern omringen. Bron: Wikimedia Commons.
Figuur 1. Model van een heliumatoom volgens de kwantummechanica. Het bestaat uit de waarschijnlijkheid wolk van de twee heliumelektronen die 100 duizend keer kleiner een positieve kern omringen. Bron: Wikimedia Commons. Volgens de kwantummechanica hebben elektronen met dubbele golf deeltjesgedrag en zijn atomaire schaal diffuus en niet-specifiek. De afmetingen van het atoom worden praktisch bepaald door de uitbreiding van elektronische orbitalen rond de positieve kern.
Figuur 1 toont de structuur van het heliumatoom, dat een kern heeft met twee protonen en twee neutronen. Deze kern is omgeven door de kanswolk van de twee elektronen die de kern omringen, die honderdduizend keer kleiner is. In de volgende afbeelding ziet u het heliumatoom, met de protonen en neutronen in de kern en elektronen in orbitalen.

De grootte van een heliumatoom is in de orde van een angstrom (1 Å), dat is 1 x 10^-10 m. Terwijl de grootte van zijn kern in de orde is van een femtometer (1 fm), dat is 1 x 10^-15 m.
Ondanks dat het zo klein is in vergelijking, is 99,9% van het atoomgewicht geconcentreerd in de kleine kern. Dit komt omdat protonen en neutronen 2000 keer zwaarder zijn dan de elektronen die hen omringen.
Kan u van dienst zijn: de 31 soorten kracht in de natuurkunde en hun kenmerkenAtomaire schaal en kwantumgedrag
Een van de concepten die de meeste invloed hadden op de ontwikkeling van het atoommodel was die van dualiteit Golf - deeltje: De ontdekking dat elk materiaalobject een golf van materie heeft gekoppeld.
De formule waarmee de golflengte kan worden berekend λ Geassocieerd met een materieel object werd voorgesteld door Louis de Broglie in 1924 en is als volgt:
λ = h / (m V)
Waar H Het is de constante van Planck, M het deeg en v snelheid.
Volgens het principe van De Broglie heeft elk object een dubbel gedrag, maar afhankelijk van de schaal van interacties, snelheid en massa, kan golfgedrag bij uitstek zijn dan deeltje of vice versa.
Het elektron is licht, de massa is 9,1 × 10^-31 kg. De typische snelheid van een elektron is 6000 km/s (vijftig keer minder dan de snelheid van het licht). Deze snelheid komt overeen met energiewaarden in het bereik van tientallen elektronen-voltio.
Met de vorige gegevens, en met behulp van de De Broglie -formule, kan de golflengte voor het elektron worden verkregen:
λ = 6,6 x 10^-34 j s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Het elektron tot de typische energieën van atomaire niveaus, heeft een golflengte van dezelfde orde van grootte als die van de atomaire schaal, zodat het op die schaal ontdiderend en niet heeft.
Eerste kwantummodellen
Met het idee in gedachten dat het atomaire schaal elektron golvend gedrag heeft, werden de eerste atoommodellen op basis van kwantumprincipes ontwikkeld. Onder deze valt het atoommodel van Bohr op, wat perfect het waterstofemissiespectrum voorspelde, maar niet dat van andere atomen.
Kan u van dienst zijn: spanningsinspanning: formule en vergelijkingen, berekening, oefeningenBohr's model en vervolgens dat van Sommerfeld, waren semi-klassieke modellen. Dat wil zeggen, het elektron was als een deeltje die werd onderworpen aan de elektrostatische aantrekkingskracht van de kern die eromheen baant, bestuurd door de tweede wet van Newton.
Naast de klassieke banen, hielden deze eerste modellen rekening met dat het elektron een bijbehorende materiaalgolf had. Alleen de banen waarvan de omtrek een geheel getal was van golflengten was toegestaan, omdat degenen die niet aan dit criterium voldoen, vervaagd door destructieve interferentie.
Het is dan dat de kwantisatie van energie in de atoomstructuur voor het eerst verschijnt.
Het woord quantum komt precies voort uit het feit dat het elektron slechts enkele discrete energiewaarden in de atoom kan nemen. Dit valt samen met de bevinding van Planck, die bestond uit de ontdekking dat een frequentiestraling F Interactie met materie in energiepakketten E = H F, waar H Het is de constante van Planck.
Orbitale vorm en grootte
De radiale reikwijdte van het orbitaal wordt bepaald door de radi -golffunctienaar de. Is groter in de mate dat de energie van het elektron groeit, dat wil zeggen, in de mate dat het belangrijkste kwantumaantal toeneemt.
De radiale afstand wordt meestal gemeten in Bohr-radio's, die voor de laagste waterstofergie 5,3 x 10-11 m = 0,53 Å is.
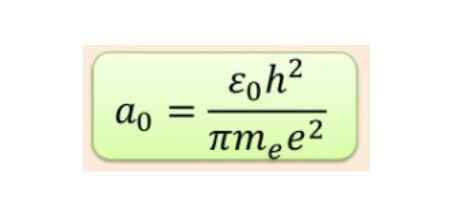 Figuur 2. Bohr Radius -formule. Bron: f. Zapata.
Figuur 2. Bohr Radius -formule. Bron: f. Zapata. Maar de vorm van de orbitalen wordt bepaald door de waarde van het kwantumnummer van hoekmomentum. Als L = 0 u een sferisch orbitaal heeft genaamd S, als u L = 1 een gelobde orbital heeft genoemd P, die drie oriëntaties kunnen hebben volgens het magnetische kwantumnummer. De volgende figuur toont de vorm van de orbitalen.
Kan u van dienst zijn: vectorgrootte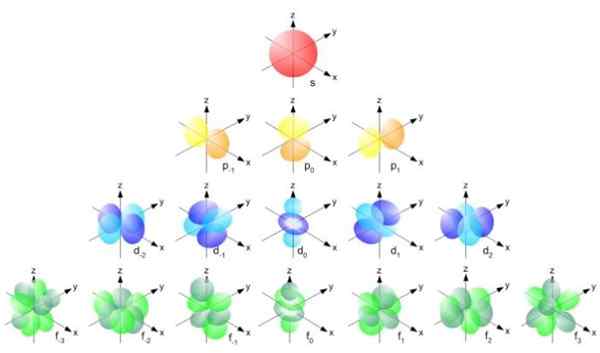 figuur 3. Vorm van de orbitalen s, p, d, f. Bron: Ucdavis chemwiki.
figuur 3. Vorm van de orbitalen s, p, d, f. Bron: Ucdavis chemwiki. Deze orbitalen zijn binnen andere verpakt volgens de energie van de elektronen. De volgende figuur toont bijvoorbeeld de orbitalen in een natriumatoom.
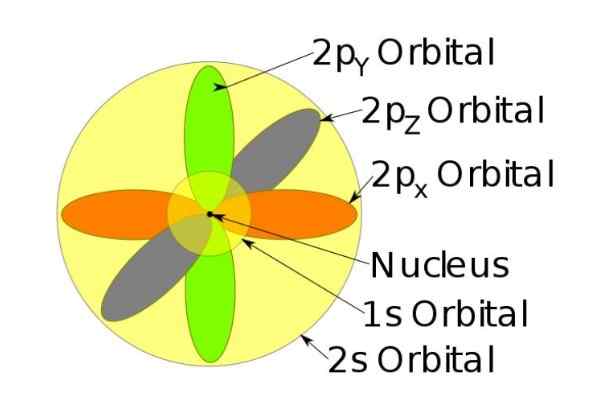 Figuur 4. Orbitalen 1s, 2s, 2p van het natriumion wanneer het een elektron heeft verloren. Bron: Wikimedia Commons.
Figuur 4. Orbitalen 1s, 2s, 2p van het natriumion wanneer het een elektron heeft verloren. Bron: Wikimedia Commons. De spin
Het kwantummechanische model van de Schrödinger -vergelijking omvat niet de elektronenspin. Maar Pauli wordt in aanmerking genomen via het uitsluitingsprincipe, dat aangeeft dat de orbitalen maximaal twee elektronen kunnen vullen met kwantum spin -nummers s = +½ en s = -½.
Het natriumion heeft bijvoorbeeld 10 elektronen, dat wil zeggen als we naar de vorige figuur verwijzen, er zijn twee elektronen voor elk orbitaal.
Maar als het het neutrale natriumatoom is, zijn er 11 elektronen, waarvan de laatste een 3s orbitaal zou bezetten (niet getoond in de figuur en van een grotere straal dan de 2s). De spin van het atoom is beslissend in de magnetische kenmerken van een stof.
Referenties
- Alonso - Finn. Kwantum- en statistische stichtingen. Addison Wesley.
- Eisberg - Resnick. Kwantumfysica. Limusa - Wiley.
- Gasiorowicz. Kwantumfysica. John Wiley & Sons.
- HSC. Natuurkunde cursus 2. Jacaranda Plus.
- Wikipedia. Schrodinger Atomic Model. Hersteld van: Wikipedia.com

