Sulfhydrinezuur (H2S) structuur, eigenschappen, gebruik, belang
- 4347
- 1036
- Aaron Okuneva
Hij sulfhydrinezuur o Waterstofsulfide is een gas gevormd door de vereniging van een zwavelatoom (s) en twee waterstofatomen (H). De chemische formule is h2S. Het is ook bekend als sulfidegas. Het is een kleurloos gas waarvan de geur duidelijk wordt in rotte eieren.
Het is aanwezig in vulkanen en zwavelachtige warmwaterbronnen, in aardgas en ruwe olie. Het wordt ook gevormd tijdens anaërobe (zonder zuurstof) ontleding van planten- en dierlijke organische stof. Het komt van nature voor in het lichaam van zoogdieren, door de werking van bepaalde enzymen op cysteïne, een niet -essentieel aminozuur.
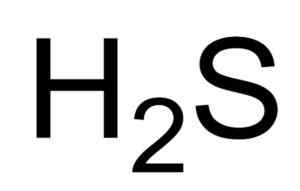
 Chemische formule van sulfhydrinezuur of waterstofsulfide. Saranphong Yimklan [Public Domain]. Bron: Wikimedia Commons.
Chemische formule van sulfhydrinezuur of waterstofsulfide. Saranphong Yimklan [Public Domain]. Bron: Wikimedia Commons. De waterige oplossingen van h2S zijn corrosief voor metalen zoals staal. De H2S is een reducerende verbinding die, wanneer ze reageren met de SO2 , Het oxideert elementaire zwavel terwijl het naar dit wordt verminderd2 Ook om zwavel te maken.
Ondanks dat het een zeer giftige en fatale verbinding is voor mens en dieren, is het belang ervan al enkele jaren bestudeerd in een reeks belangrijke processen in het lichaam.
Reguleert een reeks mechanismen die verband houden met het genereren van nieuwe bloedvaten en het functioneren van het hart.
Neuronen beschermen en hebben gedacht aan zijn actie tegen ziekten zoals Parkinson en Alzheimer.
Vanwege de chemische reducerende kan de bestrijding van oxiderende soorten, waardoor ze worden uitgevoerd tegen celveroudering. Vanwege deze redenen wordt de mogelijkheid om medicijnen te produceren onderzocht dat, wanneer ze aan patiënten worden geleverd, het langzaam in het lichaam kan vrijgeven.
Dit zou dienen om pathologieën zoals ischemie, diabetes en neurodegeneratieve ziekten te behandelen. Hun werkingsmechanisme en hun veiligheid moeten echter nog steeds diepgaand worden onderzocht.
[TOC]
Structuur
De H Molecula2S is analoog aan dat van water, dat wil zeggen dat ze op hun vorm lijken omdat hydrogenen zich bevinden en een hoek vormen met zwavel.
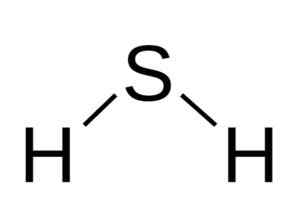 Hoekstructuur van het sulfidezuurmolecuul, h2S. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons.
Hoekstructuur van het sulfidezuurmolecuul, h2S. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons. Zwavel in h2S heeft de volgende elektronische configuratie:
1s2, 2s2 2 p6, 3S2 3P6,
Neem vervolgens een elektron van elke waterstof om zijn valentielaag te voltooien.
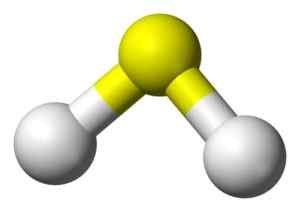 3D -structuur van sulfidezuur. Geel: zwavel. Wit: waterstof. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
3D -structuur van sulfidezuur. Geel: zwavel. Wit: waterstof. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
- Sulfhydrinezuur
- Waterstofsulfide
- Zwavelhydride.
Fysieke eigenschappen
Fysieke staat
Kleurloos gas van zeer onaangename geur.
Molecuulgewicht
34.08 g/mol.
Smeltpunt
-85.60 ºC.
Kookpunt
-60,75 ºC.
Dikte
1.1906 g/l.
Oplosbaarheid
Matig in water oplosbaar: 2,77 volumes in 1 water bij 20 ºC. Het kan volledig uit de waterige oplossing worden ontstaan door het in een kook te verzenden.
Chemische eigenschappen
In waterige oplossing
Wanneer waterstofsulfide zich in waterige oplossing bevindt, wordt de naam van sulfhydrinezuur toegewezen. Het is een zwak zuur. Het heeft twee ioniseerbare protonen:
H2S + H2Of ⇔ h3OF+ + HS-, KA1 = 8,9 x 10-8
HS- + H2Of ⇔ h3OF+ + S2-, KA2 ∼ 10-14
Het eerste proton is licht geïoniseerd, zoals kan worden afgeleid uit zijn eerste ionisatieconstante. Het tweede proton is heel weinig geïoniseerd, maar de oplossingen van H2S bevatten iets van de zwavelanionen2-.
Als de H -oplossing2S wordt blootgesteld aan de lucht, de O2 Oxida tot sulfide -anion en zwavel neerslaan:
Kan u van dienst zijn: oxiden2 s2- + 4 H+ + OF2 → 2 H2O + 2 s0↓ (1)
In aanwezigheid van chloor CL2, Bromo Br2 en jodium i2 De overeenkomstige waterstof en zwavel wordt gevormd:
H2S + BR2 → 2 HBr + S0↓ (2)
De waterige oplossingen van h2S zijn corrosief, produceren stresscracking met sulfide in hoog harde staal. Corrosieproducten zijn ijzer- en waterstofsulfide.
Zuurstofreactie
De H2S reageert met de zuurstof van de lucht en de volgende reacties kunnen optreden:
2 H2S + 3 O2 → 2 H2O + 2 dus2 (3)
2 H2S + O2 → 2 H2O + 2 s0↓ (4)
Reactie met metalen
Het reageert met verschillende metalen die naar waterstof gaan en metaalsulfide vormen:
H2S + PB → PBS + H2↑ (5)
Reactie met zwaveldioxide
In de vulkanische gassen zijn de h aanwezig2S en de SO2, die met elkaar reageren en vaste zwavel wordt gevormd:
H2S + So2 → 2 H2O + 3 s0↓ (6)
Ontleding met temperatuur
Waterstofsulfide is niet erg stabiel, het wordt gemakkelijk verbroken door te verwarmen:
H2S → H2↑ + s0↓ (7)
Locatie in de natuur
Dit gas wordt van nature aangetroffen in sulfideische of zwavelachtige warmwaterbronnen, in vulkanische gassen, in ruwe olie en aardgas.
 Zwavelachtig water manantiaal. Николай максимович [cc door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons.
Zwavelachtig water manantiaal. Николай максимович [cc door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons. Wanneer olie (of gas) significante sporen van h bevat2Van S wordt gezegd dat het "zuur" is, in tegenstelling tot "zoet", dat is wanneer het het niet bevat.
Kleine hoeveelheden h2S in olie of gas zijn economisch schadelijk omdat een wasfabriek moet worden geïnstalleerd om deze te verwijderen, zowel om corrosie te voorkomen als om resterende gas veilig te maken voor huishoudelijk gebruik als brandstof.
Het treedt op wanneer het organische materie dat zwavel bevat, wordt ontleed onder anaërobe omstandigheden (afwezigheid van lucht), zoals mens, dieren en plantenafval.
 H emissies2S (blauwachtig groene kleur) aan de kust van Namibië, gefotografeerd door NASA. Deze emissies komen van organisch afval. NASA's Earth Observatory [CC door 2.0 (https: // creativeCommons.Org/licenties/door/2.0)]. Bron: Wikimedia Commons.
H emissies2S (blauwachtig groene kleur) aan de kust van Namibië, gefotografeerd door NASA. Deze emissies komen van organisch afval. NASA's Earth Observatory [CC door 2.0 (https: // creativeCommons.Org/licenties/door/2.0)]. Bron: Wikimedia Commons. De bacteriën aanwezig in de mond en in het maagdarmkanaal produceren het uit de afbreekbare materialen die groenten of dierlijke eiwitten bevatten.
De karakteristieke geur zorgt ervoor dat zijn aanwezigheid in rotte eieren wordt gewaarschuwd.
De H2S Het komt ook voor bij bepaalde industriële activiteiten, zoals in olieraffinaderijen, cola -ovens, papieren fabrieken, die je zou hebben en in voedselverwerking.
Synthese in het lichaam van zoogdieren
De H2S endogeen kan optreden in zoogdierweefsels, onder deze mens, door twee paden, een enzymatische en een niet -enzymatische.
Het niet -enzymatische pad bestaat uit het verminderen van elementaire zwavel0 naar h2S door glucose -oxidatie:
2 c6H12OF6 (glucose) + 6 s0 (zwavel) + 3 H2O → 3 c3H6OF3 + 6 H2S + 3 CO2 (8)
Kan u van dienst zijn: chloor: geschiedenis, eigenschappen, structuur, risico's, gebruikHet enzymatische pad bestaat uit h h2S van de L-cysteïne, een aminozuur is gesynthetiseerd door het lichaam. Het proces wordt verzekerd door verschillende enzymen, zoals cystation.
 Sulfhydrinezuur is gevonden in de hersenen van koeien. Auteur: Arttower. Bron: Pixabay.
Sulfhydrinezuur is gevonden in de hersenen van koeien. Auteur: Arttower. Bron: Pixabay. Verkrijgen in het laboratorium of industrieel
Waterstofgas (h2) en het zwavelelement (s) reageren niet op normale omgevingstemperaturen, maar hierboven beginnen ze te worden gecombineerd, de optimale temperatuur is 310 ºC.
Het proces is toch te langzaam, dus andere methoden worden gebruikt om het te verkrijgen, onder deze het volgende.
Metaalsulfiden (zoals ferromesulfide) reageren met zuren (zoals waterchloor) in verdunde oplossing.
FES + 2 HCl → FECL2 + H2S ↑ (9)
Op deze manier wordt het gas verkregen2S die, gezien de toxiciteit, veilig moeten worden verzameld.
Industrieel gebruik van h2S om zwavel te produceren
Opslag en transport in grote hoeveelheden h2S die scheidt van aardgas door wassen met amines is moeilijk, dus het clausproces wordt gebruikt om het in zwavel te maken.
 In de olieraffinaderijen is de H gescheiden2S aardgas door te wassen met amines en wordt dan zwavel. Auteur: Satyaprem. Bron: Pixabay.
In de olieraffinaderijen is de H gescheiden2S aardgas door te wassen met amines en wordt dan zwavel. Auteur: Satyaprem. Bron: Pixabay. In dit proces treden twee reacties op. In de eerste de h2S reageert met zuurstof om dit te geven2, Zoals hierboven vermeld (zie reactie 3).
De tweede is een reactie die wordt gekatalyseerd door ijzeroxide waar de SO2 wordt verminderd en h2S oxideert en de twee produceren zwavel s (zie reactie 6).
Op deze manier wordt zwavel verkregen, die gemakkelijk kan worden opgeslagen en getransporteerd, evenals toegewezen aan meerdere toepassingen.
Nut of belang van h2S endogeen in het organisme
De H2S endogeen is degene die op natuurlijke wijze in het organisme voorkomt als onderdeel van het normale metabolisme bij mensen, zoogdieren en andere levende wezens.
Ondanks de lange -staande reputatie van een giftig en giftig gas geassocieerd met de ontleding van organische stof, hebben verschillende recente studies van de jaren 2000 tot heden vastgesteld dat h2S endogeen is een belangrijke regulator van bepaalde mechanismen en processen in het levende wezen.
De H2S presenteert hoge lipofiliciteit of affiniteit tegenover vetten, zodat het celmembranen gemakkelijk kruist, waardoor alle soorten cellen worden doordringt.
Cardiovasculair systeem
Bij zoogdieren bevordert of reguleert sulfidezuur een reeks signalen die metabolisme, hartfunctie en celoverleving reguleren of reguleren.
Het heeft een krachtig effect op het hart, bloedvaten en circulerende bloedelementen. Moduleert cellulair metabolisme en mitochondriale functie.
Verdedigt de nieren van de schade veroorzaakt door ischemie.
Maagdarmstelsel
Speel een belangrijke rol als beschermende factor tegen schade aan het maagslijmvlies. Het wordt geschat als een belangrijke bemiddelaar van gastro -intestinale motiliteit.
Het is waarschijnlijk dat het betrokken is bij de controle van insulinesecretie.
Centraal zenuwstelsel
Het werkt ook in belangrijke functies van het centrale zenuwstelsel en beschermt oxidatieve stressneuronen.
 Neuronen worden beschermd door h2S endogeen. Auteur: Gerd Altmann. Bron: Pixabay.
Neuronen worden beschermd door h2S endogeen. Auteur: Gerd Altmann. Bron: Pixabay. Naar schatting kan het beschermen tegen neurodegeneratieve ziekten zoals Parkinson's Parkinson, Alzheimer en Hunginton's Disease.
Visie -orgel
Bescherm fotoreceptorcellen tegen de retinale degeneratie geïnduceerd door licht.
Het kan u van dienst zijn: lithiumcarbonaat (Li2CO3): structuur, eigenschappen, gebruikTegen veroudering
De H2S zijn een reducterende soort kan worden geconsumeerd door verschillende oxiderende middelen die in het lichaam circuleren. Gevechts oxiderende soorten zoals reactieve zuurstofspecies en reactieve stikstofsoorten in het lichaam.
Beperk de reacties van vrije radicalen door de activering van antioxiderende enzymen die beschermen tegen de effecten van veroudering.
Genezingspotentieel van h2S exogeen geleverd
De biologische beschikbaarheid van h2S endogene hangt af van bepaalde enzymen die betrokken zijn bij de biosynthese van cysteïne bij zoogdieren.
Sommige studies suggereren dat een donor voor medicamenteuze therapie don2S kan gunstig zijn voor bepaalde pathologieën.
Het kan bijvoorbeeld nuttig zijn bij diabetespatiënten, omdat is waargenomen dat bloedvaten van diabetische dieren verbeteren met geneesmiddelen die H leveren2S exogeen.
De H2S verstrekt exogeen verhoogt angiogenese of vorming van bloedvaten, dus het zou kunnen dienen voor de behandeling van chronische ischemieziekten.
Drugs worden bedacht die H kunnen vrijgeven2Langzaam om gunstig te kunnen handelen over verschillende ziekten. De effectiviteit, veiligheid en mechanismen van hun actie moeten echter nog steeds worden onderzocht.
Risico's
De H2S is een fataal gif als het puur wordt ingeademd of zelfs 1 deel van gas in 200 delen van de lucht wordt verdund. Vogels zijn erg gevoelig voor h2S en sterf zelfs in verdunning van 1 op 1500 delen lucht.
 Sulfidezuur of waterstofsulfide H2S is een krachtig gif. Auteur: Openicons. Bron: Pixabay.
Sulfidezuur of waterstofsulfide H2S is een krachtig gif. Auteur: Openicons. Bron: Pixabay. De H2S is een krachtige remmer van bepaalde enzymen en oxidatieve fosforyleringsprocessen, wat leidt tot cel -verstikking. De meeste mensen zien het olfitorly in concentraties groter dan 5 ppb (delen per miljard). De concentraties van 20-50 ppm (delen per miljoen) zijn irritant voor de ogen en de luchtwegen.
Een inhalatie van 100-250 ppm gedurende een paar minuten kan een gebrek aan coördinatie, geheugenstoornissen en motoraandoeningen genereren. Wanneer de concentratie ongeveer 150-200 ppm is2S. Als een concentratie van 500 ppm 30 minuten wordt ingeademd, kunnen longoedeem en longontsteking worden geproduceerd.
Concentraties van meer dan 600 ppm kunnen binnen de eerste 30 minuten fataal zijn, omdat het ademhalingssysteem verlamd is. En 800 ppm is de concentratie die onmiddellijk dodelijk is voor de mens.
Daarom moet worden vermeden dat er H -ontsnappingen zijn2S in laboratoria, lokale of overal of situatie.
Het is belangrijk om te waarschuwen dat veel doden optreden omdat mensen in ruimtes aangaan die beperkt zijn om collega's of familieleden te redden die zijn ingestort door vergiftiging met H2S, ze ook sterven.
Het is een brandbaar gas.
Referenties
- Panthi, s. et al. (2016). Fysiologisch belang van waterstofsulfide: opkomende potnt neuroprotector en neuromodulator. Oxidatieve geneeskunde en cellulaire levensduur. Volume 2016. Artikel ID 9049782. Hyndawi hersteld.com.
- Shefa, u. et al. (2018). Antioxiderende en celsignalerende functies van waterstofsulfide in het centrale zenuwstelsel. Oxidatieve geneeskunde en cellulaire levensduur. Volume 2018. Artikel ID 1873962. Hyndawi hersteld.com.
- Tabassum, r. et al. (2020). Therapeutisch belang van waterstofsulfide bij leeftijdsgebonden neurodegeneratieve ziekten. Neural Regen Res 2020; 15: 653-662. Nrronline hersteld.borg.
- Martelli, a. et al. (2010). Waterstofsulfide: nieuwe kans op het ontdekken van geneesmiddelen. Medicinale onderzoeksrecensies. Deel 32, uitgave 6. Opgehaald uit de online bibliotheek.Wiley.com.
- Wang, m.-J. et al. (2010). Mechanismen van angiogese: rol van waterstofsulfide. Klinische en experimentele farmacologie en fysiologie (2010) 37, 764-771. Opgehaald uit de online bibliotheek.Wiley.com.
- Dalefield, r. (2017). Rook en andere ingeademde toxiconts. Waterstofsulfide. In veterinaire toxicologie voor Australië en Nieuw -Zeeland. Hersteld van Scientedirect.com.
- Selley, R.C. en sonnenberg, s.NAAR. (2015). De fysische en chemische eigenschappen van aardolie. Waterstofsulfide. In Elements of Petroleum Geology (derde editie). Hersteld van Scientedirect.com.
- Hocking, m.B. (2005). Zwavelzuur. Claus procesomzetting van waterstofsulfide naar zwavel. In Handbook of Chemical Technology and Pollution Control (derde editie). Hersteld van Scientedirect.com.
- Lefer, D.J. (2008). Potentieel belang van veranderingen in waterstofsulfide (h2S) Bio -beschikbaarheid bij diabetes. British Journal of Pharmacology (2008) 155, 617-619. Opgehaald van BPSPubs.Online bibliotheek.Wiley.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Waterstofsulfide. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- Port, J.NAAR. en Ibarz, J. (1965). Moderne algemene chemie. 7e editie. Marín Editorial, s.NAAR.
- « Socialistische onderwijs oorsprong, kenmerken, principes, voorbeelden
- Neoklassieke theatergeschiedenis, kenmerken, vertegenwoordigers, werken »

