Carboxyhemoglobin -kenmerken en -effecten
- 2983
- 676
- Glen Armstrong
De carboxyhemoglobine Het is hemoglobine bevestigd aan koolmonoxide (CO). Hemoglobine is het eiwit dat zuurstof door bloed naar mensen en in veel andere gewervelde dieren transporteert.
Om zuurstof te transporteren, moet hemoglobine hieraan deelnemen. Max Perutz, een chemicus en Nobelprijs geboren in Wenen in 1914 en gedood in Cam-Bridge in 2002, genaamd "Hemoglobin Oxygen Ligning gedrag".
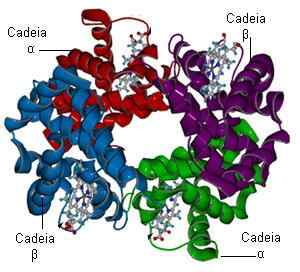
 Hemoglobinestructuur (Bron: Bielabio via Wikimedia Commons)
Hemoglobinestructuur (Bron: Bielabio via Wikimedia Commons) Stel je twee hemoglobinemoleculen voor die in staat zijn om elk te verbinden met vier zuurstofmoleculen. De ene heeft al drie zuurstofmoleculen en de andere geen. Als een ander zuurstofmolecuul verschijnt, is de vraag als volgt: bindt het aan de "rijke" die al drie heeft, of de "arme" die geen heeft? De kans is 100 tot 1 dat het rijke molecuul is gericht.
Stel je nu twee andere hemoglobinemoleculen voor. De ene heeft 4 zuurstofmoleculen (het is verzadigd) en de andere heeft er maar één. Welke van de moleculen is het meest waarschijnlijk om zuurstof aan de weefsels te geven, de rijken of de armen? De armsten zullen gemakkelijker zuurstof leveren dan rijk.
De verdeling van zuurstof in het hemoglobinemolecuul kan worden gezien als de bijbelse gelijkenis: "... wie heeft, dat zal worden gegeven en wie niet heeft, zelfs wat ze heeft, zal worden verwijderd ..." (Mt, 13:12 )). Vanuit fysiologisch oogpunt is dit "immorele" gedrag van het hemoglobinemolecuul vol betekenis, de positie draagt bij aan de bijdrage van zuurstof aan de weefsels.
Koolmonoxide, echter, ongeacht het aantal zuurstofatomen dat is verenigd met een hemoglobinemolecuul, "vegen" met iedereen. Dat wil zeggen, in aanwezigheid van overvloedige CO wordt alle zuurstof bevestigd aan hemoglobine vervangen door CO.
[TOC]
Structurele kenmerken
Om te praten over carboxyhemoglobine, dat niets meer is dan een staat van hemoglobine geassocieerd met koolmonoxide, is het noodzakelijk om eerst naar hemoglobine te verwijzen.
Hemoglobine is een eiwit bestaande uit vier subeenheden gevormd door een polypeptideketen die bekend staat als globine en een niet -eiwitse natuurgroep (prothetische groep) genaamd Hemo.
Kan u van dienst zijn: BiEestadistics: History, Study of Study and ApplicationsElke Hemo -groep bevat een ijzeren atoom in een ferro -toestand (geloof2+)). Dit zijn de atomen die in staat zijn om zuurstof te verbinden zonder te oxideren.
De hemoglobine -tetrameer wordt gevormd door twee subeenheden van alfaberberg, 141 aminozuren elk en twee subeenheden van bèta -globine, 146 aminozuren elk.
Hemoglobine vormen of structuren
Wanneer hemoglobine niet is gekoppeld aan een zuurstofatoom, is de structuur van hemoglobine stijf of gespannen, het product van de vorming van zoutoplossing binnenin binnen.
De quaternaire structuur van hemoglobine zonder zuurstof (deoxigenada) staat bekend als "T" of gespannen structuur, en geoxygeneerd hemoglobine (oxyhemoglobine) staat bekend als "R" of ontspannen structuur.
De overgang van structuur T naar structuur R vindt plaats door middel van de unie van zuurstof naar het ijzeratoom van het ijzer (geloof2+) van de hemo -groep bevestigd aan elke globin -keten.
Coöperatief gedrag
De subeenheden die de structuur van hemoglobine vormen, vertonen coöperatief gedrag dat kan worden verklaard met het volgende voorbeeld.
U kunt zich het deoxygenated hemoglobinemolecuul (in structuur T) voorstellen als een wollen schaal met de zeer verborgen zuurstofbindingsplaatsen (zoomgroepen) erin.
Wanneer deze gespannen structuur zich aansluit bij een zuurstofmolecuul, is de snelheid van de Unie erg traag, maar deze unie is voldoende om de bal een beetje los te maken en de volgende hemo -groep naar het oppervlak te brengen, waardoor de snelheid waarmee het de volgende zuurstof bindt, groter is, Het proces herhalen en de affiniteit vergroten met elke vakbond.
Koolmonoxide -effecten
Om de effecten van koolmonoxide op bloedtransport van gassen te bestuderen, is het eerst noodzakelijk.
Kan u dienen: Briology: wat is, geschiedenis, welke studiesDe oxihemoglobine -curve heeft een sigmoïde of "S" vorm die varieert afhankelijk van de gedeeltelijke zuurstofdruk. De curve -grafiek is duidelijk uit de analyses die zijn gemaakt naar de bloedmonsters die worden gebruikt om deze te bouwen.
Het meest hellende gebied van de curve wordt verkregen met drukken onder 60 mmHg en bij grotere druk dan dit, de curve heeft de neiging om plat te maken, alsof het een plateau bereikt.
Wanneer in aanwezigheid van bepaalde stoffen, kan de curve aanzienlijke afwijkingen vertonen. Deze afwijkingen vertonen veranderingen die optreden in de affiniteit van hemoglobine als gevolg van zuurstof tot dezelfde PO2.
Om dit fenomeen te kwantificeren, werd de maat voor de affiniteit van hemoglobine door zuurstof geïntroduceerd, bekend als de P -waardevijftig, dat is de gedeeltelijke zuurstofdrukwaarde waaraan hemoglobine 50% verzadigd is; dat wil zeggen, wanneer de helft van hun hemomroepen verenigd zijn met een zuurstofmolecuul.
In standaardomstandigheden, die moeten worden begrepen als pH 7.4, gedeeltelijke 40 mmHg zuurstofdruk en 37 ° C temperatuur, p, pvijftig Onder een volwassen man is 27 mm Hg of 3,6 kPa.
Welke factoren kunnen de affiniteit van hemoglobine beïnvloeden door zuurstof?
De affiniteit voor de zuurstof van de hemoglobine in de erytrocyten kan afnemen in aanwezigheid van 2,3 defosposfoglyceraat (2-3dpg), van kooldioxide (CO (CO2), van hoge concentraties van protonen of door verhoogde temperatuur; En hetzelfde geldt voor koolmonoxide (CO).
Functionele implicaties
Koolmonoxide is in staat om de zuurstoftransportfunctie in arterieel bloed te verstoren. Dit molecuul kan hemoglobine samenvoegen en carboxyhemoglobine vormen. Dit komt omdat het een affiniteit heeft voor hemoglobine ongeveer 250 keer groter dan de O2, Dus hij is in staat om het te verplaatsen, zelfs als hij aan haar is gekoppeld.
Kan u van dienst zijn: Czapek Agar: foundation, voorbereiding, gebruik en beperkingenHet lichaam produceert permanent koolmonoxide, hoewel in kleine hoeveelheden. Dit gas, kleurloze en toilet, sluit zich aan bij de Hemo -groep op dezelfde manier als het of2, En normaal zijn er ongeveer 1% bloedhemoglobine zoals carboxyhemoglobine.
Aangezien de onvolledige verbranding van organisch materiaal CO produceert, is het aandeel carboxyhemoglobine bij rokers veel hoger en kan het waarden bereiken tussen 5 en 15% van de totale hemoglobine. De chronische toename van de concentratie Carboxyhemoglobin is schadelijk voor de gezondheid.
Een toename van de hoeveelheid CO die is inademt die meer dan 40% carboxyhemoglobine genereert, bedreigt het leven. Wanneer de ijzerbindingsplaats van het ijzer wordt bezet door een CO, kunt u de O niet raken2.
De CO -vakbond produceert de overgang van hemoglobine naar structuur R, zodat hemoglobine het vermogen om te leveren of te leveren2 In bloedcapillairen.
Carboxyhemoglobine heeft een lichte rode kleur. Dus, patiënten vergiftigd met CO nemen een roze kleur aan, zelfs in een coma en ademhalingsverlamming toestand. De beste behandeling om te proberen het leven van deze patiënten te redden, is om pure, zelfs hyperbare zuurstofinademen te maken, om te proberen de unie van ijzer met CO te verplaatsen.
Referenties
- Fox, s. Je. (2006). Menselijke fysiologie 9e editie (PP. 501-502). McGraw-Hill Press, New York, VS.
- Murray, r. K., Granner, D. K., Mayes, p. NAAR., & Rodwell, V. W. (2014). Harper's geïllustreerde biochemie. McGraw-Hill.
- Rawn, J. D. (1998). Biochemistry (1989). Burlington, North Carolina: Neil Patterson Publishers (c) n. Lalioti, CP Raptopoulou, een. Terzis, a. Panagiotopoulos, sp perlepes, en. Manessi-zouopa, j. Chem. SOC. Dalton Trans, 1327.
- Robert M. Berne, Matthew n. Heffing. (2001) Fysiologie. (3e ed.) Harcourt -edities, s.NAAR.
- West, J. B. (1991). Fysiologische basis van de medische praktijk. Williams & Wilkins
- « Kwalitatieve evaluatiekenmerken, voordelen, voorbeelden
- Observationele leertheorie, kenmerken, voorbeelden »

