Berkelio (BK) structuur, eigenschappen, verkrijgen, gebruik

- 1551
- 112
- Irving McClure I
Hij berkelium Het is een chemisch element waarvan het symbool BK is. Het behoort tot de klasse van actiniden, zijnde zijn achtste lid. Uw atoomnummer is 97. Het is een synthetische metalen vaste stof. Dit element wordt niet van nature gevonden over de korst van de aarde. Het is aanwezig in kleine hoeveelheden in gebruikte nucleaire brandstoffen en heeft een zilveren glans.
Er zijn ook kleine hoeveelheden verspreid in het milieu vanwege de tests van kernwapens, vanwege ernstige ongevallen in atomaire energiefaciliteiten zoals Tsjernobyl en door de afgifte die optreedt door afval van kerncentrales.
 Symbool, nummer en atomaire massa van het Berkelio -element. Bron: me/cc by-s (https: // creativeCommons.Org/licenties/by-sa/2.5). Bron: Wikimedia Commons.
Symbool, nummer en atomaire massa van het Berkelio -element. Bron: me/cc by-s (https: // creativeCommons.Org/licenties/by-sa/2.5). Bron: Wikimedia Commons. Een praktisch nut voor Berkelio is niet gevonden, omdat het in zeer kleine hoeveelheden voorkomt en het feit dat al zijn isotopen (BK -atomen met verschillende neutronen in de kern) radioactief zijn. De belangrijkste toepassing is in wetenschappelijke studies geweest.
Hoewel hun isotopen kunstmatig worden geproduceerd in speciale laboratoria en worden afgehandeld door deskundig personeel, moet altijd rekening worden gehouden met de schade die de gevaarlijke straling heeft.
[TOC]
Nomenclatuur
- Berkelio, BK -symbool.
- Berkelio-243, BK-243 of 243BK: Berkelio isotoop met atomaire massa 243.
Ontdekking
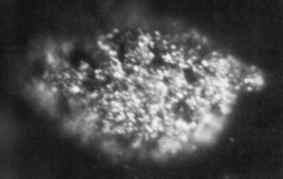 1.7 Microfotografie Microgrammen van vaste metalen Berkelio verkregen in 1969. Oak Ridge National Laboratory, US Department of Energy / Public Domain. Bron: Wikimedia Commons.
1.7 Microfotografie Microgrammen van vaste metalen Berkelio verkregen in 1969. Oak Ridge National Laboratory, US Department of Energy / Public Domain. Bron: Wikimedia Commons. Het werd voor het eerst geproduceerd in 1949 door wetenschappers Glen Seaborg, Stanley G. Thompson en Al Ghiorso aan de Berkeley University in Californië, toen ze het Amerika-241 bombardeerden met hoog-energy alpha-deeltjes met behulp van een cyclotron (een deeltjesversneller).
Onmiddellijk na bestraling werd het materiaal correct opgelost en door een ionenuitwisselingsharskolom geleid, met behulp van een ammoniumcitraatoplossing als eluent.
Op deze manier verkregen ze een isotoop van elementnummer 97 met 243 atomaire massa, die alfa -deeltjes uitzendt en een halfleven van 4,5 uur heeft.
Elementnaam
In eerste instantie stelden verschillende onderzoekers voor dat het element de naam van een van zijn ontdekkers, Glen Seaborg, aannam, omdat hij de verdienste had om 10 elementen in meerdere jaren te synthetiseren.
Kan u van dienst zijn: bekerDe officiële organisatie International Union of Pure and Applied Chemistry of IUPAC (acroniem voor Engels Internationale unie van pure en toegepaste chemie) besloot om de naam "Berkelio" toe te wijzen omdat hij was verkregen aan de universiteit en de stad Berkeley (Californië).
 Uiterlijk van een gebied van de Universiteit van Berkeley, Califronia. Auteur: Sarangib. Bron: Pixabay.
Uiterlijk van een gebied van de Universiteit van Berkeley, Califronia. Auteur: Sarangib. Bron: Pixabay. De naam Berkeley komt uit de Angloirlandés -filosoof George Barkeley, een naam waarvan de uitspraak toen veranderde in de Verenigde Staten toen de stad en de universiteit in 1869 werden opgericht.
Dat was terloops het jaar dat Dmitri Mendeléyev zijn eerste periodieke tabel publiceerde en het bestaan van nieuwe elementen zoals Berkelio begon te voorspellen.
Elektronische structuur
De elektronische configuratie is:
1S2; 2S2 2P6; 3S2 3P6 3D10; 4S2 4P6 4D10 4F14; 5S2 5P6 5D10; 6S2 6P6; 5F9 7S2,
of compact:
[RN] 5F9 7S2.
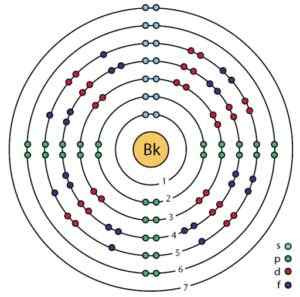 Berkelio elektronische structuur. Orbitalen en elektronen zijn te zien. Ahazard.ScienceWriter/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Berkelio elektronische structuur. Orbitalen en elektronen zijn te zien. Ahazard.ScienceWriter/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Het verkrijgen van
Het eerste monster van het metaal werd bereid in 1969 door een fluorideverminderingsreactie (BKF3) Met lithiummetaal (Li) bij een temperatuur van 1300 K.
Om dunne metalen platen te bereiden, is bko -oxide verminderd2 Met torio (th) of metalen lantano.
Berkelio's fysieke eigenschappen
Fysieke staat
Sulde metalen vaste stof.
Het Berkelio -metaal heeft twee kristallijne vormen: alfa (dubbele compacte zeshoek) en bèta (kubus gecentreerd op gezichten).
Atoom massa
247
Smeltpunt
1050 ºC (Alpha -vorm)
986 ° C (Beta -vorm)
Kookpunt
2627 ºC
Dikte
14.78 g/cm3 (Alpha -vorm)
13.25 g/cm3 (Beta -vorm)
Paramagnetisme
Volgens sommige bronnen tonen bepaalde Berkelio -verbindingen paramagnetische eigenschappen, wat betekent dat ze zich aangetrokken voelen tot magnetische velden.
Dit kenmerk is van paramagnetisch type, omdat het materiaal bij het opschorten van magnetische werking dergelijke eigenschappen niet alleen behoudt.
Chemische eigenschappen
Bij hoge temperaturen wordt de metalen Berkelio snel geoxideerd in lucht of zuurstof, waardoor zijn oxiden worden gevormd. Het is gemakkelijk oplosbaar in minerale zuren, waardoor waterstofgas h wordt vrijgeeft2 en BK -ionen vormen3+.
Kan u van dienst zijn: aluminium hydride (ALH3): structuur, eigenschappen, gebruikOxidatietoestanden
Het eerste onderzoek van dit element was beperkt tot ionenuitwisseling en coprecipitatie -experimenten, waarmee werd waargenomen dat de oxidatietoestand +3 stabiel is en de +4 toegankelijk is in waterige oplossing, sinds de BK3+ Het kan worden geoxideerd door het bromato -ion (bro4-) Om BK te geven4+.
BK stabilisatie4+
In 2017 werd de stabilisatie van de BK gemeld4+ In oplossing met behulp van de verbinding gevormd door hydroxipiridinongroepen verenigd tot een polyaminestructuur (Ligand 3,4,3-LI (1,2-HOP) genoemd)).
Deze verbinding heeft acht plaatsen waar het ion samenwerkt, die overeenkomen met de zuurstofatomen van groepen C = O en N-OH, waardoor de BK achterblijft4+ stevig gekoppeld aan ligand en blijven stabiel.
Vaste verbindingen
De BK4+ kan coprecipiteren met cerio (CE4+) of zirkonium (zr4+) in fosfaat of yodato. Het kan ook worden geëxtraheerd in BIS-hexaanoplossingen (2-ethylhexil) hydrogenofosfaat of ander soortgelijk meegaand middel.
De eerste Berkelio -verbinding die zich in zichtbare hoeveelheden voordeed, was chloride (BKCL3), van waaruit in 1962 0,000000003 gram werd verkregen. Sindsdien hebben verschillende Berkelio -verbindingen kunnen voorbereiden en studeren.
Ze kunnen bijvoorbeeld fosfaat worden genoemd (bkpo4), oxychloride (BKOCL), fluoriden (BKF3 en BKF4), Dioxide (bko2), trioxide (bk2OF3), Yodatos (bk (io3))3 en bk (io3))4), Chlorohydraat [bkcl2(H2OF)6] CL, oxalaat, organomethalische verbindingen en coördinatieverbindingen, onder andere.
Nieuwe oxidatietoestand +5
In 2018 slaagde een groep onderzoekers uit verschillende landen erin om een nitraatcomplex te produceren met pentavalent Berkelio (BK5+) wiens formule bko is2(NEE3))2-, door twee geen moleculen te elimineren2 van het BK -ion (nee3))4-, (BK3+)).
Berekeningen van computationele energieberekeningen bevestigden dat de oxidatietoestand +5 degene is die de grootste stabiliteit heeft in dit Berkenilo -nitraatcomplex, daarom de meest waarschijnlijke.
Isotopen
Van Berkelio zijn 14 isotopen met atomaire massa's gesynthetiseerd van 238 tot 251. Ze zijn allemaal radioactief.
Het kan u van dienst zijn: benchilo: benzylhydrogenen, carbocaties, benzylradicalenDe meest stabiele is Berkelio-247, wiens halfwaardetijd 1380 jaar is. Elk atoom van deze isotoop wanneer desintegratie een alfa-deeltje uitzendt en een atoom van Amerika-243 vormt.
De BK-249 heeft een halfwaardetijd van 330 dagen, lijdt bèta-verval en wordt Californio-249.
Toepassingen
Omdat ze slechts zeer kleine hoeveelheden van dit element hebben kunnen verkrijgen, heeft het alleen gebruik in basiswetenschappelijk onderzoek.
Bij het verkrijgen van zwaardere elementen
De isotoop BK-249 heeft een relatief lange halfwaardetijd en het is mogelijk.
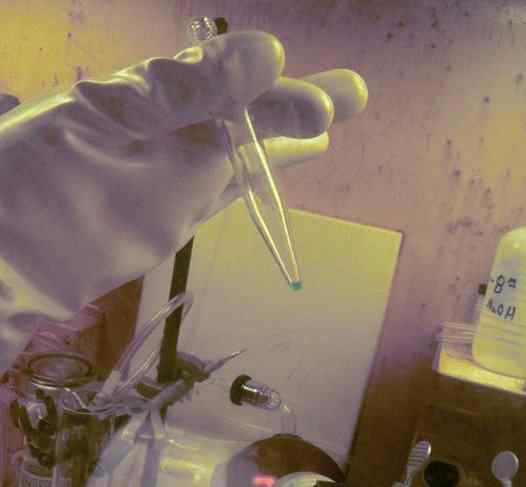 BK Microcantity opgelost in een testbuis. 250 dagen werden gebruikt om het te verkrijgen. De radioactiviteitsbeschermingshandschoen van dit element kan worden waargenomen. Ornl, Department of Energy / Public Domain. Bron: Wikimedia Commons.
BK Microcantity opgelost in een testbuis. 250 dagen werden gebruikt om het te verkrijgen. De radioactiviteitsbeschermingshandschoen van dit element kan worden waargenomen. Ornl, Department of Energy / Public Domain. Bron: Wikimedia Commons. In fysicochemische studies
Het onderzoek dat met de BK is uitgevoerd, maakt meer precieze extrapolaties mogelijk over de eigenschappen en het gedrag van andere elementen die in de acteerreeks volgen, omdat de zwaarste elementen moeilijker te verkrijgen zijn, hebben ze een zeer kort gemiddelde levens en zijn veel meer radioactief.
Risico's
Berkelio is een radioactief element. Radioactiviteitafgifte in het milieu kan alle soorten dieren en planten bereiken die hen schade veroorzaken. Achteruitgang kan zich in opeenvolgende generaties ophopen.
 Kernenergie -planten zijn radioactief en daarom erg gevaarlijk. Auteur: AR130405. Bron: Pixabay.
Kernenergie -planten zijn radioactief en daarom erg gevaarlijk. Auteur: AR130405. Bron: Pixabay. Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Berkelium - BK (element). Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Wit, f.D. et al. (2019). Hedendaagse chemie van Berkelium en Californium. Chemie 2019 6 augustus; 25 (44): 10251-10261. Hersteld van PubMed.NCBI.NLM.NIH.Gov.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Kelley, m.P. et al. (2018). Bond covalecy en oxidatietoestand van actinide-INS gecomplexeerd met therapeutisch chelatiemiddel 3,4,3-LI (1,2-Hopo). Inorged. Chem. 2018 7 mei; 57 (9): 5352-5363. Hersteld van PubMed.NCBI.NLM.NIH.Gov.
- Kovács, a. et al. (2018). Pentavalent Curium, Berkelium en Californium in nitraatcomplex: het uitbreiden van actinidechemie en oxidatietoestanden. Chem. 2018 6 augustus; 57 (15): 9453-9467. Hersteld van PubMed.NCBI.NLM.NIH.Gov.
- Orlova, een.Je. (2007). Chemie en structurele chemie van watervrije tri-toravalent actinide-orthofosfers. In structurele chemie van anorganische actinide verbindingen. Hersteld van Scientedirect.com.
- Choppin, g. et al. (2013). De elementen van actinide en transactinide. In RadioChemistry and Nuclear Chemistry (vierde editie). Hersteld van Scientedirect.com.
- Peterson, J.R. en Hobart, D.EN. (1984). De chemie van Berkelium. Advances Anorganic Chemistry, Volume 28, 1984, pagina's 29-72. Hersteld van Scientedirect.com.
- Royal Society of Chemistry. (2020). Berkelium. RSC hersteld.borg.
- « Geschiedenis van muziek uit prehistorie
- Didactische planningskenmerken, elementen, typen, voorbeeld »

