Loodjodide structuur, eigenschappen, verkrijgen, gebruik

- 3226
- 544
- Alton D'Amore
Hij Loodjodide Het is een anorganische verbinding gevormd door het loodelement (PB) in zijn oxidatie +2 en jodium (i) met Valencia -1. De chemische formule is bbp2. Het is een giftige verbinding. Omdat het leiden is schadelijk voor de mens, dieren en natuurlijke ecosystemen. Bovendien kan jodide ook enkele ziekten veroorzaken.
Het bbp -verbinding4, Dit is, met lood in oxidatie +4, het lijkt erop dat het niet bestaat, waarschijnlijk vanwege de reducerende capaciteit van het jodide -ion (i-)). Het bbp2 Het is een vaste gele kleur die weinig oplosbaar is in water.
 Loodjodide (bbp2) stevig. W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Loodjodide (bbp2) stevig. W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. Het kan worden verkregen met behulp van een ionenuitwisselingsreactie tussen een jodidezout en een lead die beide oplosbaar zijn in water.
Het heeft halfgeleider -eigenschappen, dus de meeste van zijn huidige toepassingen bevinden zich op fotovoltaïsche apparaten, detectoren van bepaalde straling en sensoren.
Een van de meest bestudeerde toepassingen van deze verbinding is die van Perovskita zonnecellen, die zeer efficiënt en lage kosten zijn gebleken.
[TOC]
Structuur
In hoofdjodide is de unie tussen zijn atomen slechts gedeeltelijk ionisch. Atomen vormen lagen met zeshoekige structuur en ze zijn aan elkaar gekoppeld door zwakke krachten van van der Waals.
Deze krachten zijn noch ionisch noch covalent, zijn zwakke interacties tussen de elektronische lagen van atomen.
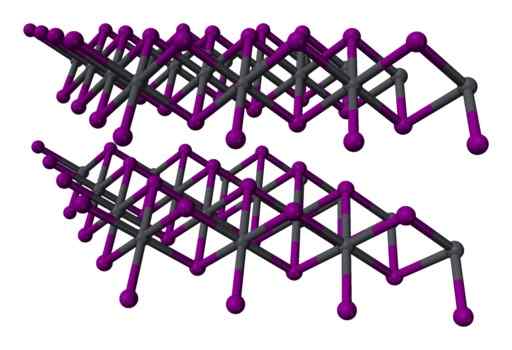 Twee layer drie -layer structuur2 kristallijn. Grijs = lood; Violet = jodium. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons.
Twee layer drie -layer structuur2 kristallijn. Grijs = lood; Violet = jodium. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons. Nomenclatuur
- Loodjodide
- Loodjodide (ii)
- Leid diyoduro
- Plumboso jodide
Eigenschappen
Fysieke staat
Felgele kristallijne vaste stof. Zeshoekige kristallen.
 Zeshoekige kristallen van loodjodide. Alessandro e Damiano/CC door (https: // creativeCommons.Org/licenties/door/4.0). Bron: Wikimedia Commons.
Zeshoekige kristallen van loodjodide. Alessandro e Damiano/CC door (https: // creativeCommons.Org/licenties/door/4.0). Bron: Wikimedia Commons. Molecuulgewicht
461 g/mol
Smeltpunt
410 ºC
Kookpunt
954 ° C, kook met ontleding.
Dikte
6.16 g/cm3
Oplosbaarheid
Licht water oplosbaar: 0,076 g/100 ml bij 25 ° C. Warm water oplosbaar. Onoplosbaar in alcohol en koud zoutzuur (HCL).
Kan u van dienst zijn: natrium: geschiedenis, structuur, eigenschappen, risico's en gebruikChemische eigenschappen
De oxiderende en reducerende eigenschappen zijn zwak. U kunt echter oxiductiereacties presenteren.
Hoewel het heel weinig oplosbaar is in water oplost in geconcentreerde oplossingen van alkalische jodiden zoals kaliumjodide (ki). Het is oplosbaar in geconcentreerde oplossing van natriumacetaat (CH3Zak). Het lost vrij op in natriumthiosulfaatoplossing (NA2S2OF3)).
Sommige auteurs geven aan dat in water de ionen PBI kan worden gegenereerd+ En als er overtollig ionen is (i-) Meer complexe soorten zoals BBP kunnen worden gevormd3- en BBP42-, onder andere.
Het is niet ontvlambaar.
Andere fysieke eigenschappen
Het gedraagt zich als een halfgeleider, dat wil zeggen dat het al dan niet elektriciteit kan leiden, afhankelijk van de omstandigheden waaraan het is onderworpen.
Het is een directe gap halfgeleider, dat wil zeggen dat een van zijn elektronen van de Valencia -band naar het rijden gaat, het moet slechts een hoeveelheid energie hebben die gelijk is aan de verboden bandbreedte.
Vanwege het hoge atoomnummer van zijn elementen (Pb = 82, i = 53) heeft het een hoge foto -elektrische capaciteit. De 2,5 Ever Gap -band maakt een hoge efficiëntie van fotovoltaïsche prestaties mogelijk bij temperaturen tot 250 ° C.
Het verkrijgen van
Het kan worden bereid door een in water oplosbare verbinding te reageren met iarhydiczuur (HI) of met een oplosbaar metaaljodide. Een waterige oplossing van loodacetaat met kaliumjodide is bijvoorbeeld gemengd:
PB (CH3COO)2 + 2 ki → bbp2↓ + 2 K (kies3COO)
Dit type reactie staat bekend als "ionenuitwisseling" omdat kationen en anionen worden uitgewisseld tussen zouten.
In het genoemde voorbeeld is kaliumacetaat zeer oplosbaar in water en blijft het opgelost, terwijl kaliumjodide, minder oplosbaar zijn, neerslaan en filteren. Zuivering wordt gedaan door de verbinding in water te herkristalliseren.
Kan u van dienst zijn: kristallisatiePBI -neerslag2 Het is te zien in de volgende afbeelding die een testbuis toont waar loodnitraat (II) (PB (nee3))2) en kaliumjodide (ki) in waterige oplossing. Dit effect wordt "goud van goud" genoemd.
 Regen van goud van het bbp2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Regen van goud van het bbp2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Toepassingen
Als halfgeleider
Het wordt gebruikt als een detector voor fotonen met een hoge energie zoals x -reeks en gammastralen. Het kan worden gebruikt in fotovoltaïsche apparaten, fotocellen, LED -verlichting, optische detectoren en in biologische classificatie en sensoren.
Indien geïntroduceerd in nanostructuren kan het worden gebruikt in fotokatalyse en zonnecellen. Bovendien zijn veel bbp nanodeeltjes2 Ze hebben luminescerende eigenschappen.
 Leadjodide wordt gebruikt in X -Ray Medical Detectors. Auteur: LKCJJang40090. Bron: Pixabay.
Leadjodide wordt gebruikt in X -Ray Medical Detectors. Auteur: LKCJJang40090. Bron: Pixabay. Zonnepanelen
Het bbp2 Het is een intermediair in de synthese van perovskitas bestemd voor zonnecellen. Dit type fotovoltaïsche cellen bevatten methylammonium en loodjodide (kies3NH3BBP3) Op basis van oom2.
Dergelijke apparaten hebben een hoge efficiëntie en lage kosten, dus ze zijn veel studie en onderzoek geweest.
 Zonnecellen op het dak van een huis in het veld. De zonnecellen waarin PBI wordt gebruikt2 Ze zijn zeer efficiënt en zijn niet erg duur, dus ze kunnen in de toekomst in huizen worden gebruikt. Auteur: Manfred Antranias Zimmer. Bron: Pixabay.
Zonnecellen op het dak van een huis in het veld. De zonnecellen waarin PBI wordt gebruikt2 Ze zijn zeer efficiënt en zijn niet erg duur, dus ze kunnen in de toekomst in huizen worden gebruikt. Auteur: Manfred Antranias Zimmer. Bron: Pixabay. Sinds Cho3NH3BBP3 Het kan afbreken met regenwater, er is onderzocht hoe vervuilend deze cellen kunnen zijn, zowel wanneer ze in gebruik zijn als wanneer ze worden weggegooid.
De ch3NH3BBP3 Bij contact met water breekt het in methylamine (kies3NH2), Yodhydric acid en bbp2. De laatste, hoewel het in de loop van de tijd weinig oplosbaar in water is2+.
De studies zijn niet overtuigend, omdat de plaats waar looduitgifte plaatsvindt om te bepalen of het bedrag op de korte termijn schadelijk kan zijn. Aan de andere kant kan een voortdurende release bioaccumuleren en erg gevaarlijk zijn.
Kan u van dienst zijn: butanone: structuur, eigenschappen en gebruikAndere apps
- Het wordt gezaaid in de vorm van spray in de wolken om regen te produceren.
- In filters voor astronomie van de verre infrarood.
- In fotografie, indrukken, films om optische afbeeldingen op te nemen, fotografische emulsies.
- In remcoating. In smeervetten.
- Mercury Steam Arc -lampen. Op elektrotisch papier.
- Thermo -elektrische materialen, thermische batterijen met jodium.
Risico's
Voor Veiligheid
Het moet verre worden bewaard van oxidatiemiddelen zoals peroxiden, peroxiden, permanganaten, chlorises en nitraten. Contact met chemisch actieve metalen zoals kalium, natrium, magnesium en zink moet ook worden vermeden. In al deze gevallen kan een gewelddadige reactie optreden.
Als u verwarming ondergaat, worden giftige gassen van lood en jodium gegenereerd.
Tot de gezondheid
Is zeer schadelijk voor de mens. Er is bevestigd dat het carcinogeen voor dieren is, daarom is redelijkerwijs afgeleid dat het ook voor de mens is.
Het kan hoofdpijn, prikkelbaarheid veroorzaken, geheugen verminderen en de slaap verstoren. Lood in deze verbinding kan permanente schade genereren aan nieren, hersenen, zenuwen, bloedcellen en hogedrukrisico.
Het moet worden behandeld als een teratogeen (verbinding die een aangeboren defect kan genereren). Het kan ook het jodisme veroorzaken, wiens symptomen congestie zijn van neusgaten, hoofdpijn, irritatie van slijmvliezen en cutane uitbarsting, onder andere.
Voor de natuurlijke omgeving
Het is geclassificeerd als giftige verontreinigende stof. Het moet uit de buurt van water worden gehouden en bronnen aftappen. Om te voorkomen dat besmettingsdijken moeten worden gebouwd wanneer het nodig is om het te behouden.
Het is zeer giftig voor het waterleven met effecten die in de loop van de tijd duren, omdat het bio -acumuleerbaar is.
Referenties
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Loodjodide. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Evstropiev; S.K. et al. (2020). Synthese en karakterisering van PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Link hersteld.Springer.com.
- Ismail, r.NAAR. et al. (2016). Synthese van PBI2 Nanodeeltjes door laserablatie in methanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Link hersteld.Springer.com.
- Materialen. (2013). Loodjodide (bbp2) Halfgeleider. Hersteld van Azom.com.
- CDH (2008). Lood (ii) jodide. Veiligheidsgegevensbladmateriaal. Hersteld van chdfinechemisch.com.
- HAILEGNAW, B. et al. (2015). Regen op methylammonium lood jodide -gebaseerde perovskieten: mogelijke omgevingseffecten van perovskiet zonnecellen. J. Fysiek. Chem. Lett. 2015, 6, 9, 1543-1547. Hersteld van pubs.ACS.borg.
- Wikimedia Foundation (2020). Lood (ii) jodide. Opgehaald van.Wikipedia.borg.
- « Loodacetaatstructuur, eigenschappen, verkrijgen, gebruik
- Organisatie van een objectief bedrijf, structuur, voorbeeld »

