Loodacetaatstructuur, eigenschappen, verkrijgen, gebruik

- 2496
- 206
- Cecil Graham
Hij Lood acetaat O loodacetaat (II) is een verbinding gevormd door een loodion (PB2+) en twee acetaationen (CH3Coo-)). De chemische formule is (cho3COO)2PB of ook PB (kies3COO)2.
Het staat ook bekend als "loodsuiker" voor het hebben van een zoete smaak. Het is echter een zeer giftige stof. Het is een zeer oplosbare kristallijne vaste stof in water. U kunt gemakkelijk reageren met waterstofsulfide (h2S) Het genereren van bruin loodsulfide (PBS), dat wordt gebruikt bij de detectie van dit giftige gas in industriële processen.
 Vaste lood (ii) acetaat. Dormoothemist bij Engelse Wikipedia/CC door (https: // creativeCommons.Org/licenties/door/3.0). Bron: Wikimedia Commons.
Vaste lood (ii) acetaat. Dormoothemist bij Engelse Wikipedia/CC door (https: // creativeCommons.Org/licenties/door/3.0). Bron: Wikimedia Commons. In de oudheid werd het met relatief gemak verkregen, dus het had gebruik die momenteel volledig verboden zijn vanwege de toxiciteit van deze verbinding.
Loodacetaatpoeder mag niet worden verspreid in de omgeving, omdat het explosieve mengsels met zuurstof vormt. Bovendien is het een carcinogene verbinding voor dieren en mensen.
Het wordt gemakkelijker in organische weefsels geabsorbeerd dan andere loodverbindingen. Het heeft de neiging om bioaccumuleren in levende wezens, dus het mag niet worden weggegooid naar de omgeving.
[TOC]
Structuur
Het loodacetaat (II) heeft de structuur weergegeven in de onderstaande afbeelding:
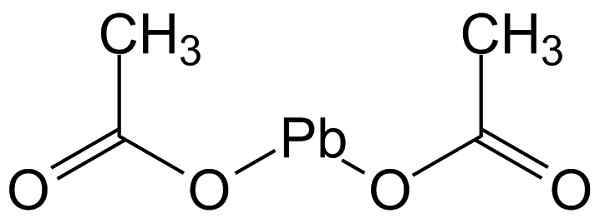 Moleculaire structuur van loodacetaat (II). Michał Sobkowski/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Moleculaire structuur van loodacetaat (II). Michał Sobkowski/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. Nomenclatuur
- Loodacetaat (II)
- Lood diacetaat
- Leid ethanoaat
- Plumboso -acetaat
- Leadsuiker
- Saturnus zout
Eigenschappen
Fysieke staat
Kristallijn vaste kleurloos tot wit.
Molecuulgewicht
325 g/mol
Smeltpunt
280 ºC
Kookpunt
Kook niet. Hij breekt af wanneer hij wordt verwarmd.
Dikte
3,25 g/cm3
Oplosbaarheid
Zeer oplosbaar in water: 44,3 g/100 ml bij 20 ° C. Onoplosbaar in alcohol.
pH
Een waterige oplossing tot 5% heeft een pH van 5,5-6,5.
Chemische eigenschappen
Wanneer de PB (Ococh3))2 Het lost op in water dat een deel als volgt is geïoniseerd:
PB (Ococh3))2 → PB2+ + 2 ch3Coo-
Een deel van de moleculen is echter niet geïoniseerd en blijft in de vorm:
Ch3COO-PB-OCOCH3.
Wanneer het PB -ion2+ Voer oplossing gedeeltelijk in hydrolyseert in water dat de PB -soorten genereert4(OH)44+.
Waterige PB (II) Acetaatoplossingen Los loodoxide op (PBO).
Het kan je van dienst zijn: butenoReageert met waterstofsulfide (h2S) om een bruine lead van loodsulfide (PBS) te vormen.
PB (Ococh3))2 + H2S → PBS + 2 CH3COOH
Als een waterige ammoniakoplossing wordt toegevoegd (NH3) Een wit neerslag of wit acetaat vaste stof van basicacetaat wordt gevormd tot een lead van loodacetaat.
Andere eigenschappen
Zendt een geur vergelijkbaar met die van azijn. Het heeft een zoete smaak. De meest voorkomende commerciële vorm is PB Trihydraat (CH3COO)2 •3H2OF.
 Lood acetaattrihydraat. Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Lood acetaattrihydraat. Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Het verkrijgen van
Het kan worden bereid door oxide of loodcarbonaat (II) op te lossen in geconcentreerd azijnzuur. Kleine dunne metalen loodplaten kunnen ook worden gebruikt.
PBO + 2 CH3COOH → (Ch3COO)2PB + H2OF
Oude toepassingen
In de geneeskunde
Het werd in verdunde oplossing gebruikt om het aan te brengen als kompres en gewassen in ontstekingen veroorzaakt door gifsumak en als samentrekkend in lotions. Ook om diarree te behandelen.
In veterinaire behandelingen
Het werd gebruikt als een samentrekkende en kalmerende lotion bij de behandeling van oppervlakkige ontstekingen en kneuzingen.
In cosmetica
Het werd vervaardigd in de oude Romeinse tijd. Sommige vrouwen brachten het op hun gezicht toe om bleek te lijken, wat niet alleen een mode was, maar ook een kwestie van sociale status.
Een witte teint gaf aan dat de vrouw niet tot de arbeidersklasse behoorde, maar tot de hoogste niveaus van de Romeinse samenleving. En dit gebeurde ondanks het feit dat de artsen van die tijd, zoals Plinio El Viejo, enkele van zijn schadelijke effecten kenden.
Als zoetstof van drankjes
Vanwege zijn zoete smaak werd het in de oudheid gebruikt als vervanging voor suiker, vooral in wijn en om fruit te zoeten en te behouden.
In verschillende toepassingen
Sommige van deze toepassingen zijn nog steeds van toepassing, maar de geraadpleegde literatuur is er niet duidelijk over:
- In chromen pigmenten, als een component in lijmverf, in droge organische zepen voor schilderijen, vernissen en inkten, zoals waterafstotende, in anti -bitverven.
- In het proces van het verkrijgen van goud door cyaniden, om metalen met lood te bedekken.
- Als bijtend in katoenen kleurstoffen, component van het fixeren van baden voor afdrukpapier met zonlicht.
- Om luifels en buitenmeubels te behandelen en zo te voorkomen dat agenten worden verwijderd die beschermen tegen schimmel en regenverdediging.
Huidig gebruik
In H -detectie2S
In bepaalde industriële processen wordt het gebruikt om giftige h te detecteren2S in gasvormige stromen door een proefrol waarin het als indicator dient. De detectielimiet is 5 ppm (delen per miljoen).
 Loodacetaat (II) maakt het mogelijk om H te detecteren2S in industriële gassen zodat dit giftige gas niet in de atmosfeer wordt vrijgegeven. Auteur: Leestilltaolcom. Bron: Pixabay.
Loodacetaat (II) maakt het mogelijk om H te detecteren2S in industriële gassen zodat dit giftige gas niet in de atmosfeer wordt vrijgegeven. Auteur: Leestilltaolcom. Bron: Pixabay. In recente tests is nanofibras opgenomen samen met een polymeer dat resulteert in een nieuw detectiemateriaal dat de aanwezigheid van 400 ppb (delen per miljard) van H mogelijk maakt2S zelfs vocht van 90%.
Het hoge potentieel van dit nanomateriaal als een colorimetrische sensor maakt het van toepassing op de detectie van H2S in de adem van mensen die lijden aan halitose, waarvan het bereik lager is dan 1 ppm.
 De nieuwe nanovezels die PB bevatten (CH3COO)2 Ze kunnen zeer kleine hoeveelheden h detecteren2S in adem. Auteur: Natalia Ovarenko. Bron: Pixabay.
De nieuwe nanovezels die PB bevatten (CH3COO)2 Ze kunnen zeer kleine hoeveelheden h detecteren2S in adem. Auteur: Natalia Ovarenko. Bron: Pixabay. Bij het verkrijgen van andere verbindingen
Het maakt het mogelijk om andere loodverbindingen te bereiden zoals carbonaat en chromaat, loodzouten van een hoog molecuulgewicht en antioxidantvetzuren voor rubber.
Voor extern gebruik
Volgens sommige geraadpleegde bronnen wordt deze verbinding nog steeds gebruikt in haarkleurstoffen waarvan de applicatie -indicaties waarschuwen dat het niet in andere delen van het lichaam moet worden gebruikt, anders dan de hoofdhuid.
Het maakt ook deel uit van extern gebruik analgetische producten en huidbeschermers.
In beide gevallen is er echter niet voldoende bewijs om de mate van beveiliging van deze producten vast te stellen, dus in landen als Canada en in de Amerikaanse staat Californië is het gebruik ervan in alle soorten cosmetica of voor toepassing verboden op de huid.
Risico's
Voor Veiligheid
Het is geen brandstof, maar het is verspreid in de omgeving in de vorm van fijne deeltjes kan explosieve mengsels met de lucht genereren.
Het moet verre worden bewaard van oxiderende verbindingen, sterke zuren en chemisch actieve metalen, en in gebieden zonder afvoeren of toegang tot riolen die leiden tot riolering.
Tot de gezondheid
Het kan de ogen, het luchtwegkanaal en het spijsvertering irriteren, een hoofdpijn, misselijkheid, braken, koliek, spierzwakte, krampen, epileptische aanvallen, verlamming, duizeligheid, bewustzijn, coma en zelfs dood veroorzaken,.
Het kan u van dienst zijn: hyposulfurous zuurLoodacetaat wordt ongeveer 1,5 keer sneller geabsorbeerd dan andere loodverbindingen.
 Loodacetaat heeft een negatieve invloed op de hersenen van kinderen. Auteur: Pete Lyforth. Bron: Pixabay.
Loodacetaat heeft een negatieve invloed op de hersenen van kinderen. Auteur: Pete Lyforth. Bron: Pixabay. Een zeer lage bloedconcentraties bij kinderen kunnen hyperactiviteit of neuroconductuele handicap veroorzaken, omdat het effecten op het zenuwstelsel genereert. Het kan ook bloedarmoede en schade aan de nieren veroorzaken.
In het geval van dieren is voldoende bewezen dat het giftig is voor reproductie, carcinogeen en teratogeen. Geschat wordt dat mensen op dezelfde manier van invloed zijn.
Voor het milieu
Het wordt beschouwd als een gevaarlijke stof voor het milieu, omdat het een giftige verontreinigende stof is. Het is zeer schadelijk voor waterorganismen. Speciale aandacht moet worden besteed aan vogels, zoogdieren, bodemvervuiling en waterkwaliteit.
Bioacumulatie van deze verbinding bij planten en dieren kan optreden. Internationale ecologische instellingen staan er sterk niet toe om het milieu binnen te gaan omdat het aanhoudend is.
Historische vergiftigingszaak
Een van de bestudeerde evenementen was die van de president van de Verenigde Staten Andrew Jackson (1767-1845), die een behandeling onderging met "loodsuiker", die op dat moment een traditionele remedie was met verschillende doeleinden.
In 1999 werden maatregelen genomen tot twee haarmonsters verkregen in het leven van de president en bleek dat loodniveaus zeer hoog waren in beide monsters, wat compatibel is met de symptomen van het plumisme die leden.
 Andrew Jackson was bedwelmd door op lood gebaseerde remedies. Auteur: Gordon Johnson. Bron: Pixabay.
Andrew Jackson was bedwelmd door op lood gebaseerde remedies. Auteur: Gordon Johnson. Bron: Pixabay. Zowel hun letters als hun biograaf beschrijven dat hij symptomen presenteerde zoals misselijkheid, buikkrampen en paralytisch reuma, onder anderen. Maar na een tijdje verliet Jackson de behandeling van loodacetaat, dus verbeterde zijn gezondheid.
Daarom wordt geschat dat zijn dood waarschijnlijk niet te wijten was aan loodvergiftiging.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Lood (ii) acetaat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Ghazi, een.M. en Millette, J.R. (1964). Leiding. Lood acetaat. In forensisch milieu. Hersteld van Scientedirect.com.
- Mushak, p. (2011). Leid- en volksgezondheid. In sporenmetalen en oher -verontreinigingen in de hinder. Hersteld van Scientedirect.com.
- Cha, j.-H. et al. (2018). Subrekken-per-miljoen waterstofsulfide colorimetrische sensor: lood-ached nanovezels naar halitosis diagnose. Anal Chem 2018 7 augustus; 90 (15): 8769-8775. NCBI hersteld.NLM.NIH.Gov.
- Wikimedia Foundation (2020). Lood (ii) acetaat. Opgehaald van.Wikipedia.borg.
- Stewart, s. (2015). "Glanzend en dodelijk wit". Een eerlijke teint. In de geschiedenis van de toxicologie en de gezondheid van het milieu. Hersteld van Scientedirect.com.
- Deppisch, L.M. et al. (1999). Andrew Jackson's blootstelling aan Mercurius en lood: vergiftigde president? Jama 1999 11 augustus; 282 (6): 569-71. NCBI hersteld.NLM.NIH.Gov.
- « Lood nitraatstructuur, eigenschappen, verkrijgen, gebruik
- Loodjodide structuur, eigenschappen, verkrijgen, gebruik »

