Chlooroxide (v) eigenschappen, structuur, gebruik

- 2808
- 840
- Pete Heaney V
Hij Chlooroxide (V) Het is een zeer onstabiele anorganische verbinding waarvan de chemische formule Cl is2OF5. Het is een van de vele chlooroxiden, die worden gekenmerkt door moleculaire, of zelfs radicale soorten.
De Cl2OF5 Hij heeft alleen het leven op papier en theoretische berekeningen gevonden; Het bestaan ervan is echter niet uitgesloten en het is waarschijnlijk dat sommige kunnen worden gekenmerkt (door geavanceerde spectroscopietechnieken))). Wat vanwege algemene chemieconcepten kan worden voorspeld van dit oxide, is dat het het anhydride van het chloorzuur is, HCLO3.
 CL2O5 -molecuul. Bron: Jynto [CC0].
CL2O5 -molecuul. Bron: Jynto [CC0]. Het hypothetische chlooroxidemolecuul (V) wordt hierboven getoond (V). Merk op dat omdat het een molecuul is, de aanwezigheid van de CL+5; Nog minder wanneer hij zo'n polariserende kracht moet hebben om zuurstof te forceren en covalent te verbinden.
Zoals elke onstabiele verbinding, geeft het energie vrij om te ontleden in stabielere producten; Verwerk dat in veel gevallen explosief is. Wanneer de Cl2OF5 Het breekt de vrijheid af2 I2. Het is theoretiseerd dat in het water, afhankelijk van het isomeer van CL2OF5, Er kunnen verschillende chlooroxoacides worden gevormd.
[TOC]
Eigenschappen
De molaire massa van de Cl2OF5 is 150.9030 g/mol. Uit deze massa en zijn hypothetische molecuul kan worden vermoed dat als het kan worden geïsoleerd, dit waarschijnlijk een olieachtige vloeistof zou zijn; Natuurlijk vergelijken het met het fysieke uiterlijk van de CL2OF7.
Hoewel het niet kan worden geïsoleerd of gekarakteriseerd, is dit chlooroxide zuur, covalent en moet het ook een klein dipoolmoment hebben. De zuurgraad is begrijpelijk als de chemische vergelijking van zijn hydrolyse wordt geanalyseerd:
Kan u van dienst zijn: Amagat Law: uitleg, voorbeelden, oefeningenKlet2OF5 + H2Of 2hclo3
De HCLO zijn3 Het chloorzuur. De omgekeerde reactie zou ertoe leiden dat het zuur kan worden uitgedroogd:
2HCLO3 => Cl2OF5 + H2OF
Aan de andere kant, wanneer de CL2OF5 Zodra het zich voordoet, ontleedt het:
2cl2OF5 => 4CLO2 + OF2
Het is daarom een intermediaire soort in plaats van een oxide op de juiste manier. De ontleding moet zo snel zijn (gezien het feit dat de CL zelfs wordt gevormd2OF5), die niet kon worden gedetecteerd door huidige instrumentale analysetechnieken.
Chlooroxidestructuur (V)
Molecuul
In het bovenste beeld werd de structuur van het hypothetische CL -molecuul getoond2OF5 Met een bollen en barsmodel. Rode bollen vertegenwoordigen zuurstofatomen en groen tot chloor. Elk chloor heeft een trigonale piramide -omgeving, dus de hybridisatie ervan moet SP zijn3.
Dus het CL -molecuul2OF5 Het kan worden gezien als twee trigonale piramides gekoppeld door een zuurstof. Maar als het zorgvuldig wordt waargenomen, leidt een piramide zijn zuurstofatomen naar beneden en de andere uit het vlak (in de richting van de lezer).
Vanaf hier wordt aangenomen dat er rotaties zijn in de link of2Cl-o-cl2, Het molecuul relatief dynamisch maken. Merk op dat de formule of2Koker2 Het is een manier om de structuur van de CL weer te geven2OF5.
Lewis -structuur
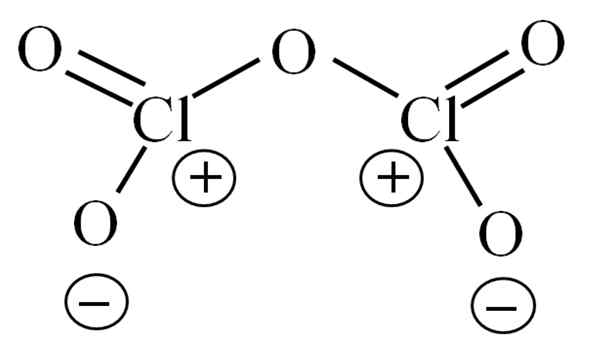 Lewis -structuur voor de hypothetische CL2O5. Bron: Gabriel Bolívar.
Lewis -structuur voor de hypothetische CL2O5. Bron: Gabriel Bolívar. Tot nu toe heeft het molecuul zelf niet toegestaan te ontcijferen naar wat zijn instabiliteit moet verschijnen. Om deze vraag licht te werpen, wordt de Lewis -structuur gebruikt, hierboven weergegeven. Merk op dat het ten onrechte kan worden gedacht dat de structuur plat is, maar in de voorste subsectie werd het verduidelijkt dat het niet zo is.
Kan u van dienst zijn: natriumazide (nan3): structuur, eigenschappen, gebruik, risico'sWaarom beide chlooratomen positieve formele belastingen hebben? Omdat chloor een paar vrij van elektronen heeft, dat kan worden geverifieerd wanneer de Valencia Link Theory wordt toegepast (wat hier vanwege vereenvoudiging niet zal worden gedaan). De formele belasting is dus:
CF = 7 - (4 + 2) = 1
En wat heeft dit te maken met uw instabiliteit? Nou, chloor is aanzienlijk elektronegatief en daarom een slechte drager van positieve formele belastingen. Dit keert terug naar de CL2OF5 Een extreem zure soort, omdat het elektronen moet krijgen om te voldoen aan de elektronische vraag van de twee chloros.
Het tegenovergestelde gebeurt met de BR2OF5 en de i2OF5, oxiden die wel in normale omstandigheden bestaan. Dit komt omdat zowel broom als jodium minder elektronegatief zijn dan chloor; En daarom ondersteunen ze de positieve formele belasting beter.
Isomeren en hun respectieve hydrolyse
Tot nu toe is de hele verklaring gedaald tot een van de twee isomeren van de CL2OF5: De O2Koker2. Dat is de andere? De O3Koker. In dit isomeer missen de chloors positieve formele belastingen en moeten daarom een stabielere molecuul zijn. Maar zowel de of2Koker2 zoals de O3Cloclo zou hydrolysereacties moeten lijden:
OF2Cl-o-cl2 + H2O => 2e2Cl-oh (die niets meer zijn dan de HCLO3))
OF3CL-O-CLO + H2O => o3Cl-oh (hclo4) + Ho-clo (hclo2))
Merk op dat maximaal drie chlooroxoacides kunnen worden gevormd: HCLO3, HCLO4 En HCLO2
Nomenclatuur
De naam 'chlooroxide (v)' komt overeen met de toegewezen volgens de voorraadnomenclatuur. De Cl2OF5 Het kan ook twee andere namen hebben: dicloro en cloor anhydride pentaoxide, toegewezen door respectievelijk systematische en traditionele nomenclatures.
Kan u dienen: Titanium: geschiedenis, structuur, eigenschappen, reacties, gebruikToepassingen
Meer dan om computerstudies te motiveren, de CL2OF5 Het zal geen gebruik maken totdat het wordt ontdekt, geïsoleerd, gekarakteriseerd, opgeslagen en heeft aangetoond dat het niet naar het minste contact ontploft.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Sandra Luján Quiroga en Luis José Perissinotti. (2011). Chlooroxoacides en structuur van dichlooroxiden. Chem. Opvoeder, vol. 16.
- Chemische formulering. (2019). Chlooroxide (V). Hersteld van: Quimica -formulering.com
- Linus Pauling. (1988). Algemene scheikunde. Dover Publications, Inc., New York.
- Richard C. Roppen. (2013). Encyclopedie van de alkalische aarde -verbindingen. Elsevier.

