IJzerhydroxide (II) structuur, eigenschappen, gebruik
- 2825
- 670
- Irving McClure I
Hij ijzerhydroxide (ii), Ook wel ferromhydroxide genoemd, het is een anorganische verbinding van Faith Chemical Formula (OH)2. Als de zuiverheid hoog is, is de vaste stof alleen samengesteld uit geloofsionen2+ en oh- In een relatie van 2: 1; Watermoleculen en verschillende ionische soorten kunnen echter bevatten, waardoor de positie verandert.
Vertegenwoordigt de "verminderde" vorm van de beroemde roest, roodachtig oppervlak bestaande uit geloofsionen3+; Terwijl in groenachtige roest, overheerst2+, Naast oh- en nog een aantal anionen: CO32-, SW42-, NEE3- en haluros (f-, Klet-,… ), Bijvoorbeeld. Het resultaat, hoewel de basis van deze groene roest geloof is (oh)2, is dat verschillende vaste stoffen worden verkregen.
 Groen oxide op ijzeroppervlak: bronmateriaal van dit type hydroxide. Bron: Pixabay.
Groen oxide op ijzeroppervlak: bronmateriaal van dit type hydroxide. Bron: Pixabay. In het dagelijks leven kan deze hydroxide op veel plaatsen worden overwogen. Het bovenste beeldschip heeft bijvoorbeeld zijn bedekte oppervlak van groene roest (niet patina). Daar is het geloof (oh)2, maar vergezeld van talloze ionen uit de golven van de zee.
Chemisch gezien zijn de eigenschappen en het gebruik van dit materiaal afhankelijk van het geloofskation2+ en van zijn neiging om te oxideren om te transformeren in geloof3+. Het is een reductiemiddel, dat snel reageert met zuurstof onder basisomstandigheden. Daarom moet het worden gebruikt in inerte atmosferen en zure oplossingen.
[TOC]
IJzerhydroxidestructuur (ii)
Links
Overweeg alleen geloof (oh)2 Puur, er zijn niets meer geloofsionen2+ en oh-.
De interacties tussen hen moeten in theorie van ionische aard zijn; Elk geloof geloof2+ trekt twee anionen aan oh-, wiens niet -directionele attracties uiteindelijk een structurele en repetitieve orde vaststellen die een kristal definiëren; Dat geeft op zijn beurt aanleiding tot groen roeststof.
Het kan u van dienst zijn: zinkhydroxide (Zn (OH) 2)Het probleem is dat er een bepaald covalent karakter is tussen beide ionen, en daarom kan een ionische Fe-OH-link niet worden genegeerd. Gezien een gedeeltelijk ionische Fe-OH-link, kan worden duidelijk dat ze zijn gegroepeerd in een soort polymere laag.
Dubbele lagen hydroxide
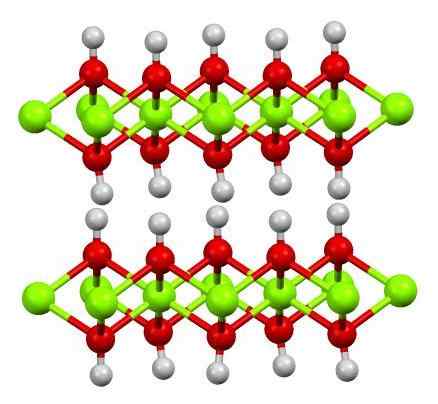
 Geloofsstructuur (oh) 2. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Geloofsstructuur (oh) 2. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] De structuur van zuivere ferromhydroxide met een model van bollen en staven wordt hierboven weergegeven. Fee2+ Ze worden vertegenwoordigd door de chillón groene bollen, terwijl oh anionen- Voor de rode en witte bollen. Merk op hoe geloofsionen zijn uitgelijnd2+ Dankzij de interacties (ionische covalente) met de OH-.
Waarom zijn deze structuur dubbele lagen hydroxiden? De afbeelding zelf biedt het antwoord: er zijn twee rijen of lagen van OH- Voor elk geloof2+; dat wil zeggen, het aandeel 2: 1 van geloof (oh) wordt gehandhaafd2 vermeld in het begin.
Structurele eenheden voor geloof (OH)2 Het zijn dan deze broodjes, waar de lagen van OH- Ze zouden de broden vertegenwoordigen; negatief geladen brood en dat faalt daarom om een opvallend bruin kristal te repareren.
Maar aan de andere kant komen H's atomen ook uit op elkaar en verdoven ze elkaar. Onthouden het concept van polariteit en elektronegativiteit, deze hydrogenen hebben een lichte positieve gedeeltelijke belasting, δ+; die, hoewel zwak, een positief gebied kunnen hebben waar andere anionen of moleculen zijn gehuisvest.
Hydrateren
Wanneer geloof (oh)2 Het lost op in het water, zijn moleculen coördineren met het metalen centrum van geloof2+ Om een complexe ACU te vormen: [geloof (h2OF)4(OH)2]. Dit complex heeft een octaëdrische geometrie voor het hebben van zes liganden: vier watermoleculen en twee OH-. In ferromhydroxide is het panorama echter een beetje anders.
Kan u van dienst zijn: wet op het behoud van materieIn Hydrate, hypothetische formule Fe (OH)2· NH2Of watermoleculen zijn exact tussen de twee lagen hydroxide ondergebracht; dat wil zeggen, ze interageren via dipool-ionen met witte hydrogenen of bollen. Het is alsof twee ohfeoh -wedstrijden zijn gepakt en water werd afgewisseld om ze te groeperen: ohfeoh (h2O) Ohfeah.
Watermoleculen zijn zeer dynamisch, waardoor hydraatdeeltjes geen aanzienlijke maten verwerven en bijgevolg een vaste colloïdale of gelei vormen.
Groene en rode roest
In hydraten hebben de hydroxidelagen afgewisselde watermoleculen; Ze kunnen echter andere anionen hebben (reeds genoemd), waardoor een breed scala aan groene herrbles wordt veroorzaakt. Ze kunnen ook moleculen "vangen" zo groot als DNA of medicijnen.
Niet alleen kunnen geloofsionen aanwezig zijn2+, Maar ook geloof3+, Product van interne oxidatie veroorzaakt door afgewisselde zuurstof. Zichtbaar zou worden opgemerkt dat groene roest (u oxide) roodachtig begint te worden naarmate de concentratie van geloof toeneemt3+.
Eigenschappen
 Testbuis met ijzerhydroxide in water. Bron: ChemicalInterest [Public Domain]
Testbuis met ijzerhydroxide in water. Bron: ChemicalInterest [Public Domain] Faith (OH) wordt hierboven weergegeven2 neerslaan in een testbuis. In overvloedig water moet de complexe ACU zich overheersen boven de nieuw genoemde structuur. Merk op dat het oppervlak eruit ziet als een oranje kleur, als gevolg van de oxidatie van het geloof2+ tot geloof3+ voor de zuurstof van de lucht; Dat wil zeggen, deze hydroxide is een reductiemiddel:
Vertrouwen2+ Vertrouwen3+ + En-
Het fysieke uiterlijk van deze verbinding in zijn puurste toestand is dat van een bruine vaste stof:
 Pure ferrohydroxide. Bron: Ondřej Mangl [Public Domain]
Pure ferrohydroxide. Bron: Ondřej Mangl [Public Domain] Die, afhankelijk van het niveau van vochtigheid, kan worden gepresenteerd als een jelly -green solid. Het is behoorlijk onoplosbaar in water (kSP= 8 · 10-16 en oplosbaarheid = 0,72 g/100 ml bij 25 ° C), en heeft een molaire massa van 89,86 g/mol en een dichtheid van 3,4 g/ml.
Het kan u van dienst zijn: de 20 soorten chemie en hun weigeringEr zijn geen kokend of fusiepunt voor deze verbinding gerapporteerd; Waarschijnlijk vanwege het feit dat het vóór een warmtebron wordt uitgedroogd en omgezet in ferro -oxide, lelijk:
Geloof (oh)2 => Lelijk + h2OF
Toepassingen
Organische kwalitatieve analyse
Het reductievermogen wordt gebruikt om de aanwezigheid van nitroverbindingen te bepalen, RNO2. De reactie waarvoor een positieve test wordt verkregen, wordt weergegeven met de volgende chemische vergelijking:
RNO2 + 6fe (oh)2 + 4h2O => rnh2 + 6fe (oh)3
Het geloof (oh)3 neerslaat als een bruin -redizo -vaste stof, die de aanwezigheid van de nitro -groep certificeert, -no2.
Selenium oxoanions reducteur
De reducerende kracht van geloof (oh)2 Het heeft ook gebruikt om SEO -anionen te verminderen32- (Selenito) en SEO42- (selenate) naar elementair selenium,. Praktisch maakt het mogelijk het verwijderen van dergelijke anionen, schadelijk voor de gezondheid, in de vorm van een onoplosbare en gemakkelijk verwijderbare Selenium Solid.
Materialen met dubbele lagen
De pure structuur en groene roest, is een bron van inspiratie voor het ontwerp van nieuwe materialen van mineralogische kenmerken.
Geschat wordt dat de functie hiervan is dat het transport van een specifieke soort tussen zijn lagen mogelijk is, op een zodanige manier dat de bevrijding ervan kan worden geregeld of gereduceerd tot de actieve plaats (bodems, cellen, metaaloppervlak, enz.)).
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). IJzer (ii) hydroxide. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). IJzershydroxide. PubChem -database. CID = 10129897. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Nick Doe. (S.F.)). Tests voor fenolen en nitrogroepen. Chemie 211. Opgehaald uit: academici.Wellesley.Edu
- Clark Jim. (27 april 2019). Chemie van ijzer. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Kingston technische software. (2019). Roestchemie. Corrosiedokters. Hersteld van: corrosiedotors.borg
- Zingaro, Ralph A. et al. (1997). Vermindering van oxoseleniumanionen door ijzer (II) hydroxide. Milieu International. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9
- « Chlooroxide (v) eigenschappen, structuur, gebruik
- Chlooroxide (III) eigenschappen, structuur, gebruik »

