Tritio
- 3140
- 269
- James Dach
Wat is het tritium?
Hij Tritio Het is de naam die is toegekend aan een van de isotopen van het chemische element van het waterstof, waarvan het symbool meestal t of is 3H, hoewel het ook wel waterstof-3 wordt genoemd. Dit wordt veel gebruikt in een groot aantal toepassingen, vooral in het nucleaire veld.
Ook is deze isotoop in de jaren dertig voor het eerst ontstaan, gebaseerd op het bombardement met hoge energiedeeltjes (deuteronen genoemd) van een ander isotoop van hetzelfde element genaamd Deuterium, dankzij de wetenschappers p p. Harteck, m. L. Oliphant en E. Rutherford.
Deze onderzoekers waren niet succesvol in het isolement van het tritium ondanks hun essays, die concrete resultaten lieten zien in de handen van Cornog en Álvarez, en ontdekten op zijn beurt de radioactieve kwaliteiten van deze stof.
Op deze planeet is tritiumproductie uiterst zeldzaam van aard, alleen afkomstig uit zulke kleine proporties dat sporen worden overwogen door atmosferische interacties met kosmische straling.
Tritio -structuur
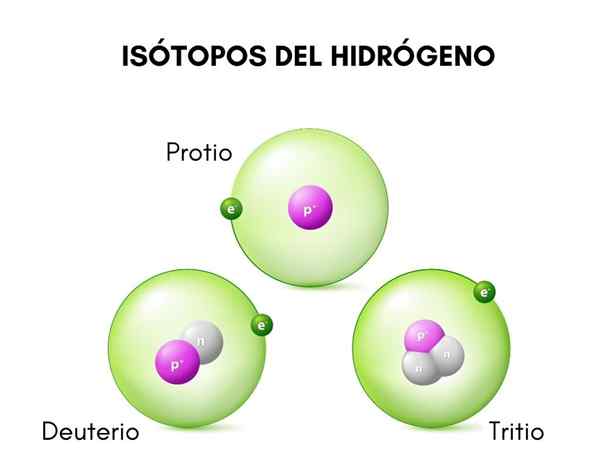
Als u het hebt over de tritiumstructuur, is het eerste dat moet worden opgemerkt zijn kern, bezitter van twee neutronen en een enkel proton, dat het een massa geeft die drie keer groter is dan die van gewone waterstof.
Deze isotoop heeft fysische en chemische eigenschappen die het onderscheiden van de andere isotopische soorten van waterstof, ondanks zijn structurele overeenkomsten.
Naast het hebben van een atoomgewicht of massa van ongeveer 3 g, vertonen deze manifeste radioactiviteitssubstantie, waarvan de kinetische kenmerken een halfwaardetijd van ongeveer 12,3 jaar vertonen.

In het bovenste beeld worden de structuren van de drie bekende isotopen van waterstof vergeleken, protio (de soort grotere overvloed), deuterium en tritium genoemd.
Het kan u van dienst zijn: Cruise for Crucible: Kenmerken, functies, gebruik voorbeeldenDoor de structurele kenmerken van het tritium kan het naast waterstof en deuterium bestaan in het water dat voortkomt uit de natuur, waarvan de productie mogelijk te wijten is aan de interactie tussen kosmische straling en stikstof van atmosferische oorsprong.
In deze zin wordt deze stof gepresenteerd in het water van natuurlijke oorsprong in een deel van 10-18 met betrekking tot gewone waterstof; dat wil zeggen, een zeer kleine overvloed die alleen als sporen kan worden herkend.
Enkele gegevens over het tritium
Verschillende manieren om Tritio te produceren zijn onderzocht en gebruikt vanwege hun hoge wetenschappelijke interesse in de eigenschappen Radioactive and Energy Use die het presenteert.
Op deze manier toont de volgende vergelijking de algemene reactie waarmee deze isotoop optreedt, van het bombardement van deuteriumatomen met deuteronen met hoge energie:
D + D → T + H
Het kan ook worden uitgevoerd als een exotherme of endotherme reactie door een proces dat neutronenactivatie van bepaalde elementen wordt genoemd (zoals lithium of boor), en afhankelijk van het element dat wordt behandeld.
Naast deze methoden kan Tritio zeldzaam zijn uit de nucleaire splijting, die bestaat uit de verdeling van de kern van een atoom dat als zwaar wordt beschouwd (in dit geval uranium- of plutonium -isotopen) om twee of meer kernen van kleine grootte te verkrijgen, die enorme hoeveelheden produceert, van energie.
In dit geval wordt het verkrijgen van Tritio gegeven als een onderpand of door het productproduct, maar het is niet het doel van dit mechanisme.
Met uitzondering van het eerder beschreven proces, worden al deze productieprocessen van deze isotopische soorten uitgevoerd in kernreactoren, waarbij de omstandigheden van elke reactie worden gecontroleerd.
Kan u van dienst zijn: pyrex glasTritio -eigenschappen
- Produceert een enorme hoeveelheid energie wanneer het afkomstig is van het deuterium.
- Het presenteert radioactiviteitseigenschappen, die wetenschappelijke interesse in nucleaire fusieonderzoek blijven wekken.
- Deze isotoop wordt in zijn moleculaire vorm weergegeven als t2 of 3H2, waarvan het molecuulgewicht ongeveer 6 g is.
- Vergelijkbaar met de Protio en Deuterium, heeft deze stof moeite om beperkt te worden.
- Wanneer deze soort wordt gecombineerd met zuurstof, ontstaat een oxide (weergegeven als t2O) dat is in een vloeibare fase en wordt algemeen bekend als superpesada -water.
- Het is in staat om fusie te ervaren met andere lichtsoorten gemakkelijker dan die van gewone waterstof.
- Het vormt een gevaar voor de omgeving als het massaal wordt gebruikt, vooral in fusieprocessen reacties.
- Het kan vormen met zuurstof, een andere stof die bekend staat als semi -gestuurd water (weergegeven als HTO), die ook radioactief is.
- Het wordt beschouwd als een lage -energie -deeltjesgenerator, bekend als bèta -straling.
- Wanneer gevallen van gemalen waterverbruik zijn gepresenteerd, is waargenomen dat het halfwaardetijd in het lichaam in het bereik van 2,4 tot 18 dagen wordt gehandhaafd, vervolgens uitgescheiden.
Gebruik/toepassingen
Onder de tritiumtoepassingen zijn de processen die verband houden met reacties van het nucleaire type. Dan wordt een lijst getoond met het belangrijkste gebruik:
- Op het gebied van radioluminescentie wordt tritium gebruikt om instrumenten te produceren die verlichting, met name de nachtelijke, in verschillende commercieel gebruiksapparaten, zoals horloges, messen, vuurwapens, onder andere, door zelfvoedsel mogelijk maken.
Het kan u van dienst zijn: Cerio Oxide (IV): structuur, eigenschappen, gebruik- Op het gebied van nucleaire chemie worden reacties van dit type gebruikt als een energiebron bij de productie van nucleaire en thermonucleaire wapens, naast gebruik in combinatie met het deuterium voor nucleaire fusieprocessen onder controle.
- Op het gebied van analytische chemie kan deze isotoop worden gebruikt in het radioactieve markeringsproces, waarbij Tritio in een specifieke soort of molecuul wordt geplaatst en u kunt volgen.
- In het geval van de biologische omgeving wordt tritium gebruikt als een overgangstracer in oceanische processen, waardoor het onderzoek naar de evolutie van de oceanen op aarde in de fysische, chemische en zelfs biologische bollen mogelijk is.
- Onder andere toepassingen is deze soort gebruikt voor de productie van een atoombatterij om elektriciteit te produceren.

