Deuterium
- 2947
- 355
- Glen Armstrong
Wat is het deuterium?
Hij deuterium Het is een van de isotopische soorten waterstof, die wordt weergegeven als d of 2H. Bovendien is de naam van zware waterstof gegeven, omdat de massa ervan tweemaal die van het proton is. Een isotoop is een soort die afkomstig is van hetzelfde chemische element, maar wiens massagummer anders is dan dit.
Dit onderscheid is te wijten aan het verschil in het aantal neutronen dat het heeft. Het deuterium wordt beschouwd als een stabiele isotoop en kan worden gevonden in verbindingen gevormd door waterstof van natuurlijke oorsprong, hoewel in een vrij klein deel (minder dan 0,02 %).
Gezien de eigenschappen, zeer vergelijkbaar met die van gewone waterstof, kan het waterstof vervangen in alle reacties waaraan het deelneemt en gelijkwaardige stoffen worden.
Om deze en andere redenen heeft deze isotoop veel toepassingen op verschillende gebieden van de wetenschap en wordt hij een van de belangrijkste.
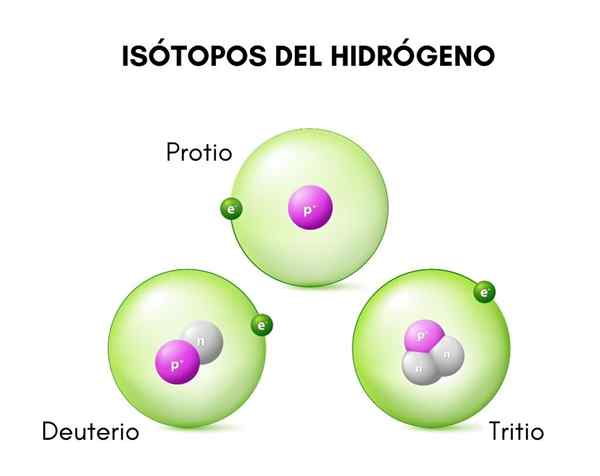
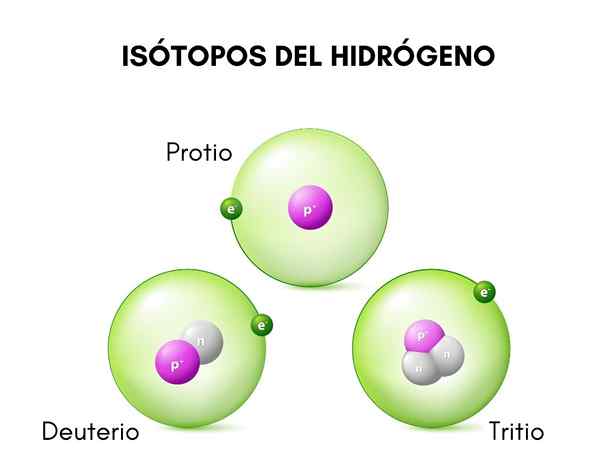
Deuterium structuur
De structuur van het deuterium wordt voornamelijk gevormd door een kern met een proton en een neutron, met een atoomgewicht of massa van ongeveer 2.014 g.
Evenzo is deze isotoop zijn ontdekking te danken aan Harold C. Urey, een chemicus uit de Verenigde Staten, en zijn medewerkers Ferdinand Brickwedde en George Murphy, in 1931.

In het bovenste beeld ziet u de vergelijking tussen de structuren van de isotopen van waterstof, die bestaat in de vorm van bescherming (de meest voorkomende isotoop), deuterium en tritium, van links naar rechts besteld.
De bereiding van het deuterium in zijn zuivere staat werd voor het eerst in 1933 met succes uitgevoerd, maar sinds de jaren 1950 is een vaste fase -substantie gebruikt en die stabiliteit heeft aangetoond, lithium deuteride (LID), voor vervanging deuterium en tritium in een groot aantal chemische reacties.
Kan u van dienst zijn: chlooroxide (iii): eigenschappen, structuur, gebruikIn die zin is de overvloed van deze isotoop bestudeerd en er is waargenomen dat de aandeel in het water enigszins kan variëren, afhankelijk van de bron waaruit het monster wordt ingenomen.
Bovendien is door spectroscopiestudies het bestaan van deze isotoop op andere planeten van dit sterrenstelsel bepaald.
Enkele gegevens over het deuterium
Het fundamentele verschil tussen de isotopen van waterstof (die de enige zijn die op verschillende manieren zijn genoemd) ligt in hun structuur, omdat de hoeveelheid protonen en neutronen van een soort zijn chemische eigenschappen verlenen.
Aan de andere kant wordt het bestaande deuterium in de stellaire lichamen geëlimineerd met een snellere snelheid dan is ontstaan.
Bovendien wordt geacht dat andere fenomenen van de natuur slechts een zeer kleine hoeveelheid ervan vormen, dus de productie ervan blijft vandaag rente genereren.
Evenzo heeft een reeks onderzoeken aangetoond dat de overgrote meerderheid van de atomen die zich uit deze soort hebben gevormd, in de oerknal zijn ontstaan; Dit is de reden waarom zijn aanwezigheid op grote planeten zoals Jupiter wordt gewaarschuwd.
Aangezien de meest voorkomende manier om deze soort in de natuur te bereiken is wanneer deze wordt gecombineerd met waterstof in de vorm van bescherming, wordt de interesse van de wetenschappelijke gemeenschap nog steeds gewekt door de relatie tussen het aandeel van beide soorten in verschillende velden van wetenschappen, als astronomie of weer.
Kan u van dienst zijn: Renio: ontdekking, eigenschappen, structuur, gebruikDeuterium -eigenschappen
- Het is een isotoop zonder radioactieve kenmerken; dat wil zeggen, het is vrij stabiel van aard.
- Het kan worden gebruikt om het waterstofatoom in chemische reacties te vervangen.
- Deze soort manifesteert een ander gedrag dan gewone waterstof in biochemische reacties.
- Wanneer de twee waterstofatomen in het water worden vervangen, wordt D verkregen2Of, de naam van zwaar water verwerven.
- De waterstof aanwezig in de oceaan die in de vorm van deuterium staat, bestaat in een aandeel van 0,016 % in relatie tot de bescherming.
- In de sterren heeft deze isotoop de neiging om snel te fuseren om helium te leiden.
- De d2Of vormt een giftige soort, hoewel de chemische eigenschappen ervan erg lijken op die van H2
- Wanneer deuteriumatomen worden onderworpen aan het nucleaire fusieproces bij hoge temperaturen, wordt de detachering van grote hoeveelheden energie verkregen.
- Fysische eigenschappen zoals kookpunt, dichtheid, verdampingswarmte, drievoudig punt, onder andere, hebben grote grootte in deuteriummoleculen (D2) dat in waterstof (h2)).
- De meest voorkomende manier waarop het wordt gevonden, is gekoppeld aan een waterstofatoom, waardoor waterstof deuteride (HD) wordt veroorzaakt.
Gebruik/toepassingen
Vanwege de eigenschappen wordt het deuterium gebruikt in een breed scala aan toepassingen waarbij waterstof bij betrokken is. Sommige van deze toepassingen worden hieronder beschreven:
- Op het gebied van biochemie wordt het gebruikt in de isotopische markering, die bestaat uit het "markeren" van een monster met de isotoop die is geselecteerd om het te volgen door de doorgang door een bepaald systeem.
Kan u van dienst zijn: sterk zuur- In kernreactoren die fusiereacties uitvoeren, wordt het gebruikt om de snelheid te verminderen waarmee neutronen bewegen zonder de hoge absorptie hiervan die de gewone waterstof presenteert.
- Op het gebied van nucleaire magnetische resonantie (NMR) worden oplosmiddelen op basis van het deuterium gebruikt om monsters van dit type spectroscopie te verkrijgen zonder de aanwezigheid van interferentie die wordt geproduceerd met behulp van gehydrogeneerde oplosmiddelen.
- Op het gebied van biologie worden macromoleculen bestudeerd door neutronenspersietechnieken, waarbij de monsters die worden geleverd met deuterium worden gebruikt om het geluid in deze contrasteigenschappen aanzienlijk te verminderen.
- In het farmacologiegebied wordt waterstofvervanging gebruikt door deuterium met het kinetische isotopische effect dat wordt gegenereerd en kan deze geneesmiddelen een langere halve leven hebben.