Siliconengeschiedenis, eigenschappen, structuur, verkrijgen, gebruik

- 2665
- 83
- Ernesto McKenzie
Hij silicium Het is een niet -metalen element en tegelijkertijd metalloïde dat wordt weergegeven door het chemische symbool als. Het is een halfgeleider, een essentieel onderdeel van computers, rekenmachines, mobiele telefoons, zonnecellen, diodes, enz.; Het is praktisch het belangrijkste onderdeel dat de afwikkeling van het digitale tijdperk heeft toegestaan.
Silicium is altijd aanwezig geweest in kwarts en silicaten, beide mineralen vormen ongeveer 28% in massa van de hele aardkorst. Het is dus het tweede meest voorkomende element op het aardoppervlak, en de uitgestrektheid van de woestijnen en stranden biedt een perspectief van hoe overvloedig het is.
 Woestijnen zijn een overvloedige natuurlijke bron van silicaruimdeeltjes of granieten met andere mineralen. Bron: Pxhere.
Woestijnen zijn een overvloedige natuurlijke bron van silicaruimdeeltjes of granieten met andere mineralen. Bron: Pxhere. Het silicium behoort tot groep 14 van het periodiek systeem, hetzelfde als koolstof, gelegen hieronder. Dat is de reden waarom dit element wordt beschouwd als een tetravalente metalloïde; Het heeft vier elektronen van Valencia en in theorie kunt u ze allemaal verliezen om het kation te vormen als4+.
Een onroerend goed dat deelt met kolen is zijn vermogen om samen te voegen; dat wil zeggen, hun atomen zijn covalent gekoppeld om moleculaire ketens te definiëren. Evenzo kan silicium zijn eigen "koolwaterstoffen" vormen, Siltans genoemd.
De overheersende verbindingen van silicium in de natuur zijn de beroemde silicaten. In zijn pure vorm kan het optreden als een solide monokristallijn, polyristaline of amorf. Het is een relatief inerte vaste stof, dus het vertegenwoordigt geen aanzienlijke risico's.
[TOC]
Geschiedenis
De siliconensteen
Silicium is misschien een van de elementen die de meeste invloed hebben gehad op de geschiedenis van de mensheid.
Dit element is de hoofdrolspeler van het stenen tijdperk, en ook van het digitale tijdperk. Hun oorsprong dateert terug toen beschavingen met Quartz werkten en hun eigen glas maakten; En momenteel is het het belangrijkste onderdeel van computers, laptops en smartphones.
Praktisch silicium is de steen van twee tijdperken die duidelijk in onze geschiedenis zijn gedefinieerd.
Isolatie
Toen het silica zo overvloedig was, een naam geboren uit de Flint Rock, moest het een extreem rijk element in de korst van de aarde bevatten; Dit was het succesvolle vermoeden van Antoine Lavoisier, die in 1787 faalde in haar pogingen om het van haar oxide te verminderen.
Enige tijd later, in 1808, deed Humphry Davy zijn eigen pogingen en gaf hij zijn voornaam aan het element: 'Silicium', dat vertaalde zou zijn als 'pedernal metal'. Dat wil zeggen, het silicium werd tegen die tijd beschouwd als een metaal vanwege het gebrek aan karakterisering.
Dan, in 1811 de Franse chemici Joseph L. Gay-Lussac en Louis Jacques Thénard slaagden erin om voor het eerst amorf silicium voor te bereiden. Hiervoor reageerden ze silicium tetrafluoride met metalen kalium. Ze zuiverden of karakteriseerden echter niet het verkregen product, dus concludeerden ze niet dat het het nieuwe silicium -element was.
Het was niets anders dan in 1823 toen de Zweedse chemicus Jacob Berzelius een amorf silicium verkreeg met voldoende zuiverheid om het als silicium te herkennen; Naam gegeven in 1817 door de Schotse chemicus Thomas Thomson bij het beschouwen van een niet -metalen element. Berzelius voerde de reactie uit tussen kalium en gesmolten kalium fluorosilicaat om dit silicium te produceren.
Kristallijn silicium
Het kristallijne silicium werd voor het eerst in 1854 bereid door de Franse chemicus Henry DeVille. Om dit te bereiken, maakte Deville een elektrolyse van een mengsel van aluminium- en natriumchloriden, waardoor siliciumkristallen bedekt werden bedekt door een laag aluminium siliciuro, die ze (blijkbaar) met water met water elimineerde met water met water.
Fysische en chemische eigenschappen
Fysiek uiterlijk
 Elementair silicium, dat een metalen glans heeft, maar het is eigenlijk een metalloïde. Bron: Hi-Res afbeeldingen van chemische elementen [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Elementair silicium, dat een metalen glans heeft, maar het is eigenlijk een metalloïde. Bron: Hi-Res afbeeldingen van chemische elementen [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Het silicium in zijn pure of elementaire vorm bestaat uit een blauwachtig grijsachtige of zwarte vaste stof (superieur beeld), dat hoewel het geen metaal is, heldere gezichten presenteert alsof het echt was.
Het is een harde maar brosse vaste stof, die ook een plaveiseloppervlak vertoont als het wordt gevormd door polyristales. Aan de andere kant ziet amorf silicium eruit als een donkerbruine vaste vaste stof. Dankzij dit is het gemakkelijk om het ene type silicium (kristallijn of polyristaline) te identificeren en te differentiëren van het andere (amorf).
Molaire massa
28.085 g/mol
Atoomnummer (z)
14 (14Ja)
Smeltpunt
1414 ºC
Kookpunt
3265 ºC
Dikte
-Bij kamertemperatuur: 2,33 g/ml
-Precies op het smeltpunt: 2,57 g/ml
Merk op dat vloeibaar silicium dichter is dan vast silicium; wat betekent dat hun kristallen op een vloeibare fase zullen drijven, zoals bij het ijswatersysteem. De verklaring is te wijten aan het feit dat de interatomische ruimte tussen de atomen als in zijn glas groter is (minder dicht), dan de overeenkomstige in de vloeistof (dichter).
Fusiewarmte
50.21 kJ/mol
Verdampingswarmte
383 kJ/mol
Molaire warmtecapaciteit
19.789 J/(mol · k)
Elektronegativiteit
1.90 op de Pauling -schaal
Ionisatie -energieën
-Eerst: 786,5 kJ/mol
-Tweede: 1577.1 kJ/mol
-Derde: 3231,6 kJ/mol
Atomaire radio
231 uur (gemeten in hun respectieve diamantkristallen)
Warmtegeleiding
149 w/(m · k)
Elektrische weerstand
2.3 · 103 Ω · m tot 20 ºC
Mohs hardheid
6.5
Aaneenschakeling
Siliciumatomen hebben de mogelijkheid om eenvoudige Si-Si-links te vormen, die uiteindelijk een keten definiëren (Si-Si-Si ...).
Deze eigenschap wordt ook gemanifesteerd door koolstof en zwavel; SP -hybridisaties3 van het silicium zijn tekortcher in vergelijking met die van de andere twee elementen en bovendien zijn hun 3p -orbitalen diffuus, dus de overlapping van de orbitalen SP3 resulterend is zwakker.
Kan u van dienst zijn: exotherme en endotherme reactiesDe gemiddelde energieën van de Si-Si en C-C covalente bindingen zijn respectievelijk 226 kJ/mol en 356 kJ/mol. Daarom zijn SI-IF-links zwakker. Daarom is silicium niet de hoeksteen van het leven (noch zwavel). In feite is het langste ketting of skelet dat silicium kan vormen meestal vier leden (als4)).
Oxidatienummers
Het silicium kan een van de volgende oxidatienummers hebben, uitgaande van het bestaan van de ionen met hun respectieve belastingen: -4 (ja4-), -3 (ja3-), -2 (ja2-), -1 (ja-), +1 (ja+), +2 (ja2+), +3 (ja3+) en +4 (ja4+)). Van al ze zijn de -4 en +4 de belangrijkste.
-4 wordt bijvoorbeeld aangenomen in siliciuros (mg2Ja of mg22+Ja4-); terwijl +4 overeenkomt met die van silica (SIO2 of als4+OF22-)).
Reactiviteit
Silicium is volledig onoplosbaar in water, evenals sterke zuren of basen. Het lost echter op in een geconcentreerd mengsel van salpeter- en fluorhorische zuren (HNO3-Hf). Evenzo lost het op in een hete alkalische oplossing, de volgende chemische reactie die optreedt:
Ja (s) + 2naOH (ac) + h2Of (l) => na2SIO3(AC) + 2H2(G)
Het natriummetasproblemen, na2SIO3, Het wordt ook gevormd wanneer silicium oplost in gesmolten natriumcarbonaat:
Ja (s) + na2CO3(L) => na2SIO3(L) + c (s)
Bij kamertemperatuur reageert het helemaal niet met zuurstof, zelfs niet bij 900 ° C, wanneer een Siio -beschermende glasvochtlaag begint te vormen2; En dan, bij 1400 ° C, reageert het silicium met de luchtstikstof om een mengsel van nitrhures te vormen, zonder en als3N4.
Silicium reageert ook bij hoge temperaturen met metalen om metalen siliciuros te vormen:
2mg (s) + ja (s) => mg2Ja (s)
2cu (s) + ja (s) => cu2Ja (s)
Bij kamertemperatuur reageert het explosief en direct met halogenen (er is geen SIO -laag2 Dat beschermt het hiertegen). U hebt bijvoorbeeld de SIF -formatiereactie4:
Ja (s) + 2f2(g) => sif4(G)
En hoewel silicium onoplosbaar is in het water, reageert Red Alive met een stoomstroom:
Ja (s) + h2Of (g) => si2(s) + 2H2(G)
Elektronische structuur en configuratie
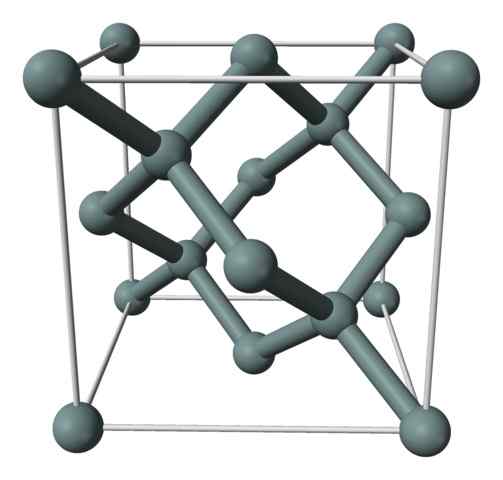 Kristallijne structuur of de eenheidscel van het silicium weergegeven met een model van bollen en staven. Bron: Benjah-bmm27 [Public Domain]
Kristallijne structuur of de eenheidscel van het silicium weergegeven met een model van bollen en staven. Bron: Benjah-bmm27 [Public Domain] Het bovenste beeld toont de kubieke structuur gecentreerd op de gezichten (FCC), dezelfde als die van de diamant, voor siliciumkristal. De grijze bollen komen overeen met de atomen als ze, zoals gewaardeerd, covalent aan elkaar zijn gekoppeld; Bovendien hebben ze tetraëdrische omgevingen die zich over het glas voortplanten.
Het siliciumkristal is FCC omdat een atoom wordt waargenomen als het zich op elk van de gezichten van de kubus bevindt (6 × 1/2). Er zijn ook acht atomen als in de hoekpunten van de kubus (8 × 1/8), en vier erin gelegen (die die een goed gedefinieerde tetraëder om hen heen tonen, 4 × 1).
Zei het bovenstaande, elke eenheidscel heeft in totaal acht siliciumatomen (3 + 1 + 4, getallen aangegeven in de bovenstaande paragraaf); Kenmerk dat helpt bij het verklaren van de hoge hardheid en stijfheid, omdat puur silicium zowel een covalent kristal als diamant is.
Covalent karakter
Dit covalente karakter is te wijten aan het feit dat silicium, net als koolstof, vier valentie -elektronen heeft volgens de elektronische configuratie:
[Ne] 3s2 3P2
Om te koppelen, zijn pure orbitalen 3s en 2p nutteloos. Daarom creëert het atoom vier SP hybride orbitalen3, Waarmee u vier si-si covalente bindingen kunt vormen en op deze manier het octet van Valencia kunt voltooien voor de twee siliciumatomen.
Het siliciumkristal wordt vervolgens gevisualiseerd als een covalent en drie -dimensionaal netwerk bestaande uit onderling verbonden tetraëderra.
Dit netwerk is echter niet perfect, omdat het defecten en korrelgrenzen presenteert, die een kristal scheiden en definiëren van een ander; En wanneer dergelijke kristallen erg klein en talrijk zijn, is er sprake van een polyristaline -vaste stof, geïdentificeerd door zijn heterogene helderheid (vergelijkbaar met een oplichte mozaïek of oppervlakte zilver).
Elektrische geleidbaarheid
SI-IF-links, met hun goed gelegen elektronen, zijn in principe niet eens met wat van een metaal wordt verwacht: een zee van elektronen die hun atomen "bevochtigen"; Dit is tenminste zo bij kamertemperatuur.
Wanneer de temperatuur toeneemt, begint silicium echter elektriciteit te stimuleren en gedraagt het zich daarom als een metaal; Dat wil zeggen, het is een halfgeleider metalloïde element.
Amorf silicium
Siliciumtetraëders nemen niet altijd een structureel patroon aan, maar kunnen op een wanordelijke manier worden gerangschikt; En zelfs, met siliciumatomen waarvan de hybridisaties SP lijken te zijn3 maar sp2, wat bijdraagt aan het verder vergroten van de mate van wanorde. Daarom is er sprake van een amorf en niet -kristallijn silicium.
In amorf silicium is er elektronische vacatures, waar sommige van hun atomen een orbitaal hebben met een elektron verdwenen. Dankzij dit kan de vaste stof zelf waterstof waterstof geven, wat aanleiding geeft tot de vorming van waterstof amorf silicium; dat wil zeggen, het heeft Si-H-banden, waarmee de Tetrahedra in wanordelijke en willekeurige posities zijn voltooid.
Kan u van dienst zijn: interatomische linksDeze sectie wordt vervolgens geconcludeerd door te zeggen dat silicium kan worden gepresenteerd in drie soorten vaste stoffen (om nog maar te zwijgen van de mate van zuiverheid): kristallijn, polyristaline en amorf.
Elk van hen heeft zijn eigen methode of productieproces, evenals de toepassingen en dilemma bij het bepalen van welke van de drie te gebruiken, wetende hun voor- en nadelen.
Waar is het en verkrijgt
 Quartz -kristallen (silica) zijn een van de belangrijkste en meest buitengewone mineralen waar silicium zich bevindt. Bron: James St. John (https: // www.Flickr.com/foto's/jsjgeology/22437758830)
Quartz -kristallen (silica) zijn een van de belangrijkste en meest buitengewone mineralen waar silicium zich bevindt. Bron: James St. John (https: // www.Flickr.com/foto's/jsjgeology/22437758830) Silicium is het zevende meest voorkomende element van het universum, en de tweede in de korst van de aarde, die ook de mantel van de aarde verrijkt met zijn enorme familie van mineralen. Dit element wordt buitengewoon goed geassocieerd met zuurstof, waardoor een breed scala aan oxiden wordt gevormd; Onder hen, silica, zo2, en silicaten (diverse chemische samenstelling).
Silica is te zien met het blote oog in de woestijnen en stranden, omdat het zand voornamelijk uit SIO is samengesteld2. Op zijn beurt kan dit oxide zich in een paar polymorfen manifesteren, die de meest voorkomende zijn: kwarts, amethist, agaat, Christobalite, Tripoli, Coesite, Stishovita en Thundimita. Bovendien is het te vinden in amorfe vaste stoffen zoals opalen en diatomea -landen.
De silicaten zijn ondertussen zelfs structureel en chemisch rijker. Onder sommige van de silicaten kunnen mineralen worden vermeld: asbest (wit, koffie en blauwachtig), veldspaat, klei, mycies, olijf, aluminosilicaten, zeolieten, amfibe en pyroxenen.
Praktisch zijn alle rotsen samengesteld uit silicium en zuurstof, met hun Si-O-stabiele bindingen, en hun silicaten en silicaten gemengd met metaaloxiden en anorganische soorten.
-Silica -reductie
Het probleem dat het verkrijgen van silicium vertegenwoordigt, is om deze Si-O-link te verbreken, waarvoor speciale ovens en een goede reductiestrategie nodig zijn. De grondstof voor dit proces is kwartsvormige silica, dat eerder beweegt totdat het een fijn poeder is.
Vanuit dit grondsilica kan het worden bereid door amorf silicium of polyristaline.
Amorf silicium
Op kleine schaal, gemaakt in een laboratorium en met de relevante maatregelen, wordt het silica gemengd met magnesiumstof in een smeltkroes en is het verbrand in afwezigheid van lucht. De volgende reactie vindt dan plaats:
SIO2(s) + mg (s) => 2mgo (s) + ja (s)
Magnesium en oxide worden geëlimineerd met een verdunde zoutzuuroplossing. Vervolgens wordt de resterende vaste stof behandeld met fluorhorinezuur, zodat deze de SIO beëindigt2 overtollig; Anders is overtollige magnesium de vorming van zijn respectieve siliciuro, mg2Ja, ongewenste verbinding voor het proces.
De SIO2 Het transformeert in SIF vluchtig gas4, die wordt teruggevonden voor andere chemische synthese. Ten slotte wordt het amorfe siliciumdeeg gedroogd onder een gaswaterstofstroom.
Een andere vergelijkbare methode om amorf silicium te verkrijgen, is om dezelfde SF te gebruiken4 eerder geproduceerd, of de SICL4 (eerder verworven). De dampen van deze siliciumhalogenuros worden geleid over vloeibaar natrium in een inerte atmosfeer, zodat de vermindering van gas kan worden gegeven zonder de aanwezigheid van zuurstof:
Sicl4(G) + 4NA (L) => Ja (S) + 4Nacl (L)
Interessant is dat met amorf silicium zonnepanelen met hoge energieprestaties worden vervaardigd.
Kristallijn silicium
Beginnend opnieuw vanaf het poedervormige silica of kwarts, worden ze naar een elektrische boogoven gebracht, waar het reageert met cola. Op deze manier is het reductiemiddel niet langer een metaal maar een koolstofachtig materiaal met hoge zuiverheid:
SIO2(s) + 2c (s) => ja (s) + 2co (g)
In de reactie wordt ook siliciumcarbide geproduceerd, SIC, dat wordt geneutraliseerd met een overmaat SIO2 (Nogmaals, de kwarts is overdreven):
2sic (s) + sio2(s) => 3si (s) + 2co (g)
Een andere methode om kristallijn silicium te bereiden, is het gebruik van aluminium als een reductiemiddel:
3SIO2(s) + 4al (l) => 3si (s) + 2AL2OF3(S)
En beginnend bij het kalium hexafluorurosilicaat, k2[SIF6], het wordt ook gereageerd met metaalaluminium of kalium om hetzelfde product te veroorzaken:
K2[SIF6] (l) + 4al (l) => 3si (s) + 6kf (l) + 4alf3(G)
Onmiddellijk lost het silicium op in gesmolten aluminium, en wanneer het systeem afkoelt, kristalliseert de eerste en scheidt zich van de tweede; dat wil zeggen, siliciumkristallen worden gevormd, die er grijsachtige kleuren uitzien.
Polyristaline silicium
In tegenstelling tot de andere synthese of producties, om polyristalisch silicium te verkrijgen, begint het met een silano -gasvormige fase, sih4. Dit gas ondergaat een pyrolyse boven 500 ° C, op een zodanige manier dat een thermische ontleding optreedt en dus zijn initiële dampen, ze eindigen siliciumpolyristallen op een halfgeleideroppervlak.
De volgende chemische vergelijking is een voorbeeld van de reactie die plaatsvindt:
Ja h4(g) => ja (s) + h2(G)
Het is duidelijk dat er geen zuurstof in de kamer zou moeten zijn, omdat het zou reageren met de SIH4:
Ja h4(g) + 2e2(g) => sio2(s) + 2H2O (g)
En de spontaniteit van de verbrandingsreactie is zodanig, dat snel optreedt bij kamertemperatuur in het gezicht.
Een andere synthetische route om dit type siliciumgedeelte van het kristallijne silicium te produceren als grondstof. Ze laten het reageren met waterstofchloride bij een temperatuur rond 300 ° C, zodat de trichlorosilano wordt gevormd:
Kan u van dienst zijn: ijzer (element): kenmerken, chemische structuur, gebruikJa (s) + 3HCl (g) => sicl3H (g) + h2(G)
En de SICL3H reageert op 1100 ºC om silicium te regenereren, maar nu polyristaline:
4sicl3H (g) => ja (s) + 3sicl4(g) + 2H2(G)
Het is voldoende om de vergelijkingen te zien om een idee te geven van werk en rigoureuze productieparameters die moeten worden overwogen.
Isotopen
Silicium is van nature en voornamelijk als de isotoop 28Ja, met een overvloed van 92,23%.
Daarnaast zijn er twee andere isotopen die stabiel zijn en daarom geen radioactief verval hebben: de 29Ja, met een overvloed van 4,67%; En 30Ja, met een overvloed van 3,10%. Zo overvloedig zijn 28Ja, het is niet verwonderlijk dat het atoomgewicht van het silicium 28.084 u is.
Het silicium kan ook in verschillende radio -isotopen zijn, waaronder de 31Ja (T1/2= 2,62 uur) en 32Ja (T1/2= 153 jaar). Anderen (22Ja - 44Als ze hebben T1/2 Zeer kort of kort (minder dan honderdste seconden).
Risico's
Puur silicium is een relatief inerte stof, dus het accumuleert meestal niet in een orgaan of weefsel, zolang de blootstelling eraan laag is. In stofvorm kan het oogirritaties veroorzaken, waardoor tranen of roodheid worden veroorzaakt, terwijl het aanraken kan veroorzaken, kan het ongemak, jeuk en peeling veroorzaken.
Wanneer de blootstelling erg hoog is, kan silicium de longen schaden; Maar zonder daaropvolgende effecten, tenzij de hoeveelheid voldoende is om verstikking te veroorzaken. Dit gebeurt echter niet met kwarts, die wordt geassocieerd met longkanker en ziekten zoals bronchitis en emfyseem.
Evenzo is puur silicium zeer zeldzaam van aard, en de verbindingen, zo overvloedig in de korst van de aarde, vertegenwoordigen geen risico voor het milieu.
Nu, met betrekking tot de organen, kunnen deze giftig zijn; Maar het hebben van velen van hen hangt af van welke wordt overwogen, evenals andere factoren (reactiviteit, pH, werkingsmechanisme, enz.)).
Toepassingen
Bouwindustrie
Siliciummineralen integreren de "steen" waarmee gebouwen, huizen of monumenten worden gebouwd. Cements, beton, stucwerk en vuurvaste stenen bestaan bijvoorbeeld uit vaste mengsels op basis van silicaten. Uit deze aanpak kan men het nut verschijnen dat dit element heeft in steden en architectuur.
Glas en keramiek
Van het silica kunnen kristallen die op optische apparaten worden gebruikt, worden vervaardigd, hetzij als isolatoren, cellen voor spectrofotometersmonsters, piëzo -elektrische kristallen of loutere glazen.
Wanneer het materiaal wordt bereid met meerdere additieven, wordt het ook veranderd in een amorfe vaste stof, bekend als glas; en bergen zand zijn meestal de bron van silica of kwarts die nodig zijn voor de productie ervan. Aan de andere kant worden met de silicaten keramische en porseleinen materialen vervaardigd.
Intertying -ideeën, silicium is ook aanwezig in ambachten en versieringen.
Legeringen
Siliciumatomen kunnen samenhangen en mengbaar zijn met een metalen matrix, dus het is een additief voor talloze legeringen of metalen; Bijvoorbeeld staal, om magnetische kernen te produceren; Bronzen, voor de productie van telefoonkabels; en aluminium, bij de productie van aluminium-Sailicio-legering voor lichte auto-onderdelen.
Daarom kan het niet alleen worden gevonden in de "steen" van gebouwen, maar ook in de metalen van hun kolommen.
Droogmiddelen
 Gelatineuze silicaballen, gebruikt als droogmiddelen. Bron: Desiccants [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Gelatineuze silicaballen, gebruikt als droogmiddelen. Bron: Desiccants [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Silica, in de vorm van gel of amorf, maakt het mogelijk om vaste stoffen te produceren die fungeren als droogmiddelen bij het vangen van de watermoleculen die de container binnenkomen en hun binnenste droog houden.
Elektronische industrie
 Polyristaal en amorf silicium worden gebruikt voor de productie van zonnepanelen. Bron: Pxhere.
Polyristaal en amorf silicium worden gebruikt voor de productie van zonnepanelen. Bron: Pxhere. Siliciumlagen van verschillende diktes en kleuren maken deel uit van computerchips, evenals met hun vaste stof (kristallijn of amorf), geïntegreerde circuits en zonnecellen zijn ontworpen.
Als halfgeleider zijn atomen opgenomen met minder (AL, B, GA) of meer elektronen (P, AS, SB) om het te transformeren in type halfgeleiders P of N, respectievelijk. Met twee silicios -vakbonden, één N en de andere P, Dioden of Light -emitters worden vervaardigd.
Siliconen polymeren
De beroemde siliconenlijm bestaat uit een organisch polymeer dat wordt ondersteund door de stabiliteit van de ketens van de Si-O-Si-banden ... als deze ketens erg lang, kort of verknoopt zijn, de eigenschappen van de verandering van siliconen polymeer, evenals hun Laatste toepassingen.
Onder het gebruik ervan kan hieronder worden vermeld:
-Lijm of lijmen, niet alleen om papieren samen te voegen, maar bouwblokken, rubbers, glazen panelen, rotsen, enz.
-Smeermiddelen in hydraulische remsystemen
-Versterkt de schilderijen en verbetert de helderheid en intensiteit van hun kleuren, tegelijkertijd waarmee u temperatuurveranderingen kunt weerstaan zonder te kraken of Carcome
-Ze worden gebruikt als waterafstotende sprays, die sommige oppervlakken of objecten droog blijven
-Ze geven persoonlijke hygiëneproducten (tandheelkundige pasta, shampoo, gels, scheermescrèmes, enz.) Het gevoel zijdeachtig te zijn
-De coatings beschermen de elektronische componenten van delicate apparaten tegen warmte en vochtigheid, zoals microprocessors
-Met siliconenpolymeren worden verschillende rubberen ballen die stuiteren nauwelijks op de grond gevallen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Silicium. Opgehaald uit: in.Wikipedia.borg
- Microchemicaliën. (S.F.)). Kristallografie van silicium. Hersteld van: microchemicaliën.com
- Lentech B.V. (2019). Periode Tabel: Silicium. Hersteld van: Lentech.com
- Marques Miguel. (S.F.)). Silicium treedt op. Hersteld van: Nautilus.Fis.UC.PT
- Hemant meer. (5 november 2017). Silicium. Hersteld van: Hemantmore.borg.in
- Pilgaard Michael. (22 augustus 2018). Silicium: voorkomen, isolatie en synthese. Hersteld van: PilgaAardelegs.com
- Dr. Doug Stewart. (2019). Feiten van siliciumelementen. Chemicool. Hersteld van: chemicool.com
- Christiana Honsberg en Stuart Bowden. (2019). Een verzameling bronnen voor de fotovoltaïsche opvoeder. Peducatie. Opgehaald uit: peducatie.borg
- American Chemistry Council, Inc. (2019). Siliconen in het dagelijks leven. Hersteld van: SEHSC.Americachemistry.com
- « Distributiestrategieën Typen en voorbeelden
- Typen productstrategie, hoe wordt het gedaan en voorbeeld »

