Basiszoutformule, eigenschappen, nomenclatuur, voorbeelden

- 4797
- 1169
- Lonnie Rohan
De Basiszout Het zijn allemaal die welke in water oplossen, oplossingen genereren met pH -waarden groter dan 7. Dit wordt uitgelegd door oh ionenvorming-, die rechtstreeks afkomstig zijn van het oplossingsproces of hydrolysebalans waar anion deelneemt.
Basiszouten bevatten anion oh- In hun vaste stoffen. Alkalische hydroxiden, zoals natrium en kalium, NaOH en KOH, worden bijvoorbeeld beschouwd als leden van deze zouten; Hoewel ze extreem bijtend zijn, verdienen ze daarom de denominatie van hydroxiden in plaats van zouten worden genoemd.
 Natriumhydroxide is een voorbeeld van basiszout
Natriumhydroxide is een voorbeeld van basiszout Andere basiszouten hebben in plaats daarvan anionen zoals carbonaat, CO32-. Carbonaat is afgeleid van koolzuur, h2CO3, Een zwak zuur. Daarom zijn carbonaatzouten, zoals calciumcarbonaat dat wordt gebruikt in antacida, geclassificeerd als basissouten. Dezelfde redenering is van toepassing op natriumbicarbonaat, nahco3, En voor alle andere bicarbonaatzouten.
Basiszouten zijn belangrijk omdat verschillende van hen helpen de zuurgraad van voedsel te neutraliseren. Ze kunnen ook worden gebruikt om dempingsoplossingen voor te bereiden op alkalische pH.
[TOC]
Definities
Basiszouten hebben twee definities die elkaar aanvullen: ze bevatten oh anionen- In hun vaste stoffen, of genereer dezelfde hydroxilli -anionen zodra hun kristallen in water oplossen.
Ongeacht de gekozen definitie, zal de pH van zijn waterige oplossingen groter zijn dan 7, en daarom zullen ze alkalisch of basic zijn.
Algemene formule van basiszouten
Geklaard wat wordt begrepen door basiszout, is de formule, hoewel niet strikt algemeen, als volgt:
MN(OH)WXOv
Waarbij m het metalen of ammoniumkation is, oh de hydroxillen, en xo het anion afgeleid van een zwak of sterk zuur. De subscripts N, W En v Hoeveel M, OH en XO vormen respectievelijk het basiszout, evenals hun verhoudingen.
Let daar op v Het kan gelijk zijn aan nul, wat betekent dat we een alkalische of alkalinoterreo -hydroxide hebben. Dit is wat er gebeurt met NaOH en KOH. Insgelijks, W Het kan nul zijn, wat betekent dat er geen ionen zijn oh-. Bijvoorbeeld de caco3 Het heeft niet oh-, En toch blijft het een eenvoudig zout.
Kan u dienen: calciumsulfide (CAS): structuur, eigenschappen, verkrijgen, gebruikUit het bovenstaande wordt geconcludeerd dat de algemene formule van basiszouten m isN(OH)WXOv, Maar niet alle zouten voldoen aan dit. Daarom is een belangrijkere factor om rekening mee te houden de aard van het XO -anion. Het zal dus bekend zijn wanneer een zout basic is, ongeacht of het al dan niet ionen heeft oh- In hun formules.
Basiszouteigenschappen
Basiszouten lossen op in water na de volgende vergelijking:
MN(OH)WXOv(s) → NM+(AC) + WOh-(AC) + vXO-(AC)
Merk op dat wanneer het oplost, oh ionen vrijgeeft- in water. Dit beïnvloedt de pH van de oplossing en wordt alkalisch met een waarde groter dan 7. Basic calciumnitraat lost bijvoorbeeld in het water op volgens hoe het volgt:
Ca (oh) nee3(s) → CA2+(AC) + OH-(AC) + Nee3-(AC)
De waarden van N, W En v Ze zijn gelijk aan 1 voor dit zout.
Aan de andere kant hebben de basische zouten die niet oh hebben-, Maar een anion afgeleid van een zwak zuur wordt gehydrolyseerd in het water:
Dief3(s) → CA2+(AC) + CO32-(AC)
CO32-(AC) + H2Of (l) ⇌ hco3-(AC) + OH-(AC)
Merk op dat het product van deze hydrolyse een OH -anion is-. Van daaruit ligt de alkaliteit van deze bases. En zoals verwacht, zijn ze echter minder basic dan die welke al de ionen hebben oh- aanwezig in hun kristallen. NaOH is bijvoorbeeld extreem eenvoudig:
NaOH (S) → NA+(AC) + OH-(AC)
Nou, laat oh ionen los- direct zodra het water raakt; Of erger nog, raakt nauwelijks vocht van de huid aan.
Kan u van dienst zijn: carbocatie: vorming, kenmerken, typen, stabiliteitAndere fysische of chemische eigenschappen van basiszouten verschillen niet te veel van die van andere neutrale of zure zouten.
Nomenclatuur
De nomenclatuur van basische zouten hangt af van de aard van het anion xo: als het monoatomisch is, of als het een oxoanion is. Deze sectie zal zich echter vooral richten op basische zouten met oh anionen-. Degenen die ze niet hebben, hebben veel gemakkelijkere nomenclaturen om te onthouden of te redeneren.
Met monoatomische anionen
Monoatomische anionen worden niet weergegeven als XO, maar als x. Ze zijn afkomstig van een HX hydraside, zoals fluoridezuur, HF of zoutzuur, HCl, enzovoort.
In deze gevallen worden ze systematisch op twee manieren genoemd:
(Numereral voorvoegsel behalve de aap) Hydroxi + anionennaam eindigend met het achtervoegsel -uro + naam van het metaal met zijn valentie tussen haakjes (als het er meer dan één heeft)
Salt Ni (OH) CL wordt bijvoorbeeld nikkelhydroxychloride (ii) genoemd.
Anionennaam met beëindiging -uro + -(numeral prefix behalve aap) hydroxide + metaalnaam en de valentie tussen haakjes
Salt Ni (OH) CL kan bijvoorbeeld ook worden genoemd als nikkelchloride-hydroxide (II).
We hebben ook de traditionele nomenclatuur, soms gemengd met de systematische:
Anionnaam gevolgd door (numeral prefix behalve de aap) basic en de naam van het metaal met de achtervoegsels -OOSO of -ICO zoals toegepast.
De Ni (OH) CL wordt bijvoorbeeld nikkelbasicchloride of basis nikkelchloride (ii) genoemd.
Met oxoanions
De systematische nomenclatuur voor basiszouten met oxoanions is een beetje ingewikkelder. De eenvoudigste versie is echter als volgt gebouwd:
(Numeral voorvoegsel) Hydroxide- (anionnaam) + van + metaalnaam en de Valencia tussen haakjes
Bijvoorbeeld geloof (oh) nee3 wordt genoemd: hydroxide-ijzer nitraat (ii).
Het heeft ook de traditionele nomenclatuur:
Basic nion + (numeral prefix) naam + metaalnaam eindigend in -oso of -ico
Kan u van dienst zijn: zuurstof: eigenschappen, structuur, risico's, gebruikDus geloof (oh) nee3 Het wordt genoemd: ferro -basic nitraat of basispruzeren nitraat (ii).
Opleiding
Basiszouten zijn het product van zuur-base neutralisaties, met name tussen een hydrie of een oxoacid met een overmaat van een basis of hydroxide:
Basis (overtollig) + zuur → Basiszout of alkalisch + water
Bijvoorbeeld CA (oh) nee3 Het wordt gevormd door het neutraliseren van salpeterzuur met een overmaat calciumhydroxide:
CA (oh)2(Overmaat) + hno3 → ca (oh) nee3 + H2OF
Een andere vorming van training zou als volgt zijn:
Geloof (oh)3(Overtollig) + H2SW4 → fe (oh) dus4 + 2h2OF
Dit zout wordt genoemd: basisch ijzersulfaat, basissijfsulfaat (III) of ijzerhydroxide-sulfaat (III).
Voorbeelden van basiszouten
 Antacida, zoals calciumcarbonaat, CACO3, zijn voorbeelden van basiszouten. Bron: Pixabay.
Antacida, zoals calciumcarbonaat, CACO3, zijn voorbeelden van basiszouten. Bron: Pixabay. Ten slotte zullen enkele andere voorbeelden van basissouten worden vermeld samen met hun eenvoudigere namen:
-Nach3COO: natriumacetaat
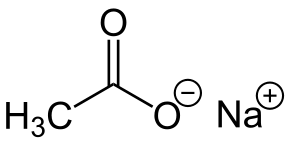 Natriumacetaat
Natriumacetaat -NA2S: Natriumsulfide
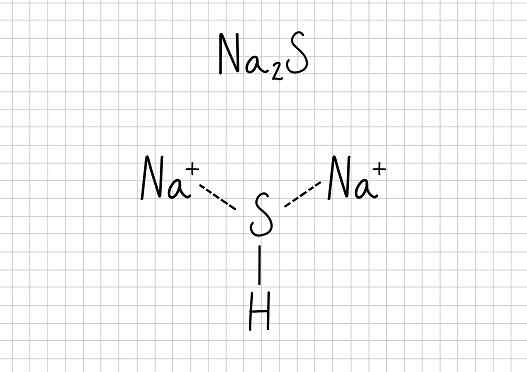 Natriumsulfide
Natriumsulfide -KCN: kaliumcyanide
-Mgco3: magnesiumcarbonaat
-Geloof (oh) dus3: Basic ijzersulfiet (iii)
-Geloof (oh) (c6H5COO)2: Basic Iron Benzoate (III)
-Aucl (oh)2: Goud dibasisch chloride (iii)
-Cuclo3(OH): Basic Copper Chlorate (ii)
-Op (oh) dus4: Basisaluminiumsulfaat
-PB (OH)2CO3: Dibasic loodcarbonaat (IV)
Het probleem van basiszouten is dat niet allemaal kunnen worden voorbereid, omdat een teveel aan basis of hydroxide niet voldoende is om ze te kristalliseren zonder toevlucht te nemen tot andere processen. Dat is het geval van PB (OH)2CO3. Dit carbonaat bestaat echter wel als een wit lood (II) pigment, waarvan de formule 2PBCO is3· PB (OH)2 of PB3(OH)2(CO3))2.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Alkali -zout. Opgehaald uit: in.Wikipedia.borg
- Wu c., Dowell C. & Hooper n. (1 juli 2014). Zure base eigenschappen van zouten. Hersteld van: chem.Librhetxts.borg
- Nicola McDougal. (2020). Zure en basiszoutoplossingen: uitleg en voorbeeld. Studie. Hersteld van: studie.com
- Probleem en chemische oefeningen. (S.F.)). Basiszout. Hersteld van: acorral.is
- « Concept- en voorbeelden Materiaalstructuur
- Spreiding van functiekenmerken, voorbeelden, oefeningen »

