Chimotripsin -kenmerken, structuur, functies, werkingsmechanisme
- 790
- 83
- Dewey Powlowski
De chimotripsin Het is het tweede meest voorkomende spijsverteringseiwit door de alvleesklier naar de dunne darm. Het is een enzym dat behoort tot de familie van de serine-proteas en is gespecialiseerd in de hydrolyse van de peptidebindingen tussen aminozuren zoals tyrosine, fenylalanine, tryptofaan, methodine en leukine aanwezig in groot eiwit.
De naam "Chemotripsin" brengt eigenlijk een groep enzymen samen die worden geproduceerd door de alvleesklier en die actief deelnemen aan darmvertering van eiwitten bij dieren. Het woord is afgeleid van de renine -actie die dit enzym heeft op maaggehalte of de "chimo".
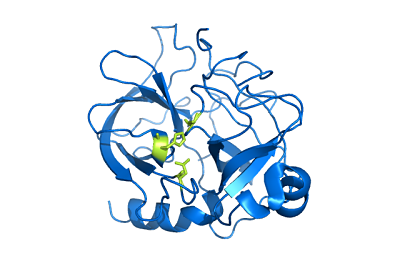
 Chimotripsin -structuur (Bron: Gebruiker: Mattyjenjen [Attribution] via Wikimedia Commons)
Chimotripsin -structuur (Bron: Gebruiker: Mattyjenjen [Attribution] via Wikimedia Commons) Hoewel het niet precies bekend is hoe breed zijn verdeling in het dierenrijk is, wordt geacht dat deze enzymen in alle lammeren aanwezig zijn en er zijn meldingen van hun aanwezigheid in "meer primitieve randen" zoals de geleedpotigen en die van de Celestroads.
Bij die dieren die alvleesklier hebben, is een dergelijk orgaan de belangrijkste plaats van de productie van chimotripsine, evenals andere proteasen, enzymatische remmers en voorlopers of zimogenen.
De chimotripsins zijn de meest bestudeerde en beter gekarakteriseerde enzymen, niet alleen in relatie tot hun biosynthese, maar ook met hun activering van zimogeen, zijn enzymatische eigenschappen, de remming ervan, zijn kinetische en katalytische kenmerken en de algemene structuur en de algemene structuur ervan en zijn algemene structuur.
[TOC]
Kenmerken en structuur
De chimotripsins zijn endopeptidasen, dat wil zeggen dat het proteasen zijn die peptidebindingen van aminozuren in "interne" posities van andere eiwitten hydrolyseren; Hoewel ook is aangetoond dat ze esters kunnen hydrolyseren, amidas en arilamidas, hoewel met minder selectiviteit.
Ze hebben een gemiddeld molecuulgewicht van ongeveer 25 kDa (245 aminozuren) en worden geproduceerd uit voorlopers die bekend staan als chemotripsinogenen.
Van de alvleesklier van runderdieren zijn 2 soorten chemotripsinogenen gezuiverd, de A en B. In het varkensmodel een derde chemotripsinogeen werd chimotripsinogeen C beschreven. Elk van deze drie zimogenen is verantwoordelijk voor de productie van respectievelijk chimotropsins A, B en C.
Het kan je van dienst zijn: Quintana Roo Flora en FaunaChimotripsin A wordt gevormd door drie polypeptideketens die covalent aan elkaar zijn gekoppeld door bruggen of disulfidebindingen tussen cysteïneresten. Het is echter belangrijk om te vermelden dat veel auteurs het als een monomeer enzym beschouwen (samengesteld uit een enkele subeenheid).
Deze ketens vormen een structuur met een ellipsoïde vorm, waarbij groepen met elektromagnetische belastingen zich naar het oppervlak bevinden (behalve aminozuren die deelnemen aan katalytische functies).
Over het algemeen zijn chimotropsins extreem actief tot zure pH, hoewel die die zijn beschreven en gezuiverd uit insecten en andere niet -verterebratedieren stabiel zijn bij pH tussen 8 en 11 en extreem onstabiel om de pH te verlagen.
Chemotripsin -functies
Wanneer de exocriene alvleesklier wordt gestimuleerd, hetzij door hormonen of door elektrische impulsen, brengt dit orgel secretoire korrels vrij die rijk zijn aan chemotripsinogeen, die eenmaal de dunne darm bereikt, wordt gesneden door een ander protease tussen afval 15 en 16 en is vervolgens "automo geprecordeerd" om een uit te voeren volledig actief eiwit.
Misschien is de belangrijkste functie van dit enzym om samen te werken met de andere uitgescheiden proteasen naar het gastro -intestinale systeem voor de spijsvertering of afbraak van de eiwitten die met voedsel worden geconsumeerd.
De producten van dergelijke proteolyse dienen vervolgens als een bron van koolstof en energie door aminozuurkatabolisme of kunnen direct worden "gerecycled" voor de vorming van nieuwe celeiwitten die meerdere en gevarieerde functies op fysiologisch niveau zullen uitoefenen.
Werkingsmechanisme
De chimotripsins oefenen hun acties alleen uit nadat ze zijn geactiveerd, omdat deze worden geproduceerd als "voorloper" (zimogeen) vormen die chemotropsinogeen worden genoemd.
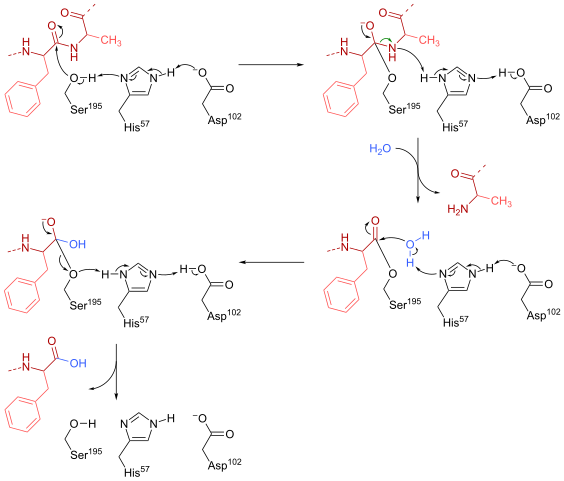 Quimotripsin -reactiemechanisme (Bron: HBF878 [CC0] via Wikimedia Commons)
Quimotripsin -reactiemechanisme (Bron: HBF878 [CC0] via Wikimedia Commons) Opleiding
De zimogenen van chimotripsin worden gesynthetiseerd door de acinaire cellen van de alvleesklier, waarna ze migreren van het endoplasmatisch reticulum naar het Golgi -complex, waar ze zijn verpakt in membraneuze complexen of secretoire korrels.
Kan u van dienst zijn: Wetenschappen die gerelateerd zijn aan de biologieDeze korrels hopen zich op aan de uiteinden van de acino's en worden vrijgegeven als reactie op hormonale stimuli of zenuwimpulsen.
Activering
Afhankelijk van de activeringsomstandigheden kunnen verschillende soorten chimotripsins worden gevonden, maar ze impliceren allemaal de proteolytische "snit" van een peptidekop in zimogeen, chimotripsinogeen, een proces dat wordt gekatalyseerd door het enzymtrips.
De activeringsreactie bestaat aanvankelijk uit de snijbinding tussen aminozuren 15 en 16 van het chimotripsinogeen, dat de π-quimotripsine vormt, in staat tot "zelfverwerking" en volledige activering van autocatalyse.
De werking van dit laatste enzym bevordert de vorming van na peptiden samen door middel van de C-terminale keten, die begint met residu 149).
De porties die overeenkomen met afval 14-15 en 147-148 (twee dipéptiden) hebben geen katalytische functies en maken los van de hoofdstructuur.
Katalytische activiteit
De chimotripsine is verantwoordelijk voor het hydrolyseren van peptidebindingen, waarbij hij voornamelijk het carbonbonische gedeelte van aminozuren met aromatische laterale groepen aanvalt, dat wil zeggen aminozuren zoals tyrosine, tryptofaan en fenylalanine.
Een serine (zijnde 195) binnen de actieve site (gly-asp-serie-gly-glu-ala-val) van dit type enzymen is misschien wel het meest essentiële residu voor de werking. Het reactiemechanisme is als volgt:
- De chimotripsine wordt aanvankelijk aangetroffen in een "substraatvrije" vorm, waarbij de katalytische "triade" bestaat uit de laterale carboxylgroep van een aspartaatresidu (102), de imidazolring van een histidineresidu (57) en de groepszijde van hydroxyl van hydroxyl van hydroxyl van hydroxyl van hydroxyl van hydroxyl van hydroxyl van hydroxyl van hydroxyl A Serine (195).
- Het substraat ontmoet het enzym en sluit zich aan bij dit om een typisch enzym-substraatomkeerbaar complex te vormen (volgens het Micaelische model), waar de katalytische "triade" de nucleofiele aanval vergemakkelijkt door de hydroxylgroep van de serine van de serine te activeren.
Het kan u van dienst zijn: stikstofbases: wat zijn, classificatie, functies- Het belangrijkste punt van het reactiemechanisme bestaat uit de vorming van een gedeeltelijke link, wat resulteert in de polarisatie van de hydroxylgroep, die voldoende is om de reactie te versnellen.
- Na de nucleofiele aanval wordt de carboxylgroep een intermediair tetraëdrische oxianion, die wordt gestabiliseerd door twee waterstofbruggen gevormd door groepen N en H van het gly -residu 193 en 195.
- Oxyanion wordt spontaan "herschikken" en een enzymatische intermediair wordt gevormd waaraan een acylgroep is toegevoegd (scherp enzym).
- De reactie gaat door met de binnenkomst van een watermolecuul tot de actieve plaats, een molecuul dat een nieuwe nucleofiele aanval bevordert die resulteert in de vorming van een tweede tetraëdrische tussenpersoon die ook wordt gestabiliseerd door waterstofbruggen.
- De reactie eindigt wanneer deze tweede intermediair opnieuw wordt herschikt en vormt opnieuw het enzym-substraat Micaeliaanse complex, waar de actieve plaats van het enzym wordt bezet door het product in de carboxylgroep.
Referenties
- Appel, W. (1986). Chymotrypsine: moleculaire en katalytische eigenschappen. Klinische biochemie, 19 (6), 317-322.
- Bender, m. L., Killheffer, J. V., & Cohen, s. (1973). Chymotrypsine. CRC Critical Reviews in Biochemistry, 1 (2), 149-199.
- Blow, D. M. (1971). 6 De structuur van chymotrypsine. In de enzymen (vol. 3, pp. 185-212). Academische pers.
- Blow, D. M. (1976). Structuur en mechanisme van chymotrypsine. Accounts of Chemical Research, 9 (4), 145-152.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Polgár, l. (2013). Katalytische mechanismen van serine- en threoninepeptiden. In handboek van proteolytische enzymen (PP. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hypothese voor het werkingsmechanisme van chymotrypsine. Proceedings of the National Academy of Sciences of the United States of America, 43 (11), 969.
- « Benzylzuursynthese, transpositie en gebruik
- Visuele leerkenmerken, strategieën, activiteiten, voorbeelden »

