Keratinetypen, structuur, locatie en functies
- 2149
- 233
- Lonnie Rohan
De keratine Het is een onoplosbaar vezelachtig eiwit dat een structureel onderdeel van de cellen is en de integumenten van veel organismen, vooral van gewervelde dieren. Het heeft zeer gevarieerde vormen en is weinig reactief, chemisch gezien.
De structuur ervan werd voor het eerst beschreven door wetenschappers Linus Pauling en Robert Corey in 1951, terwijl ze de structuur van dierenhaaranalyseren. Deze onderzoekers gaven ook aanwijzingen over de structuur van myosine van spierweefsel
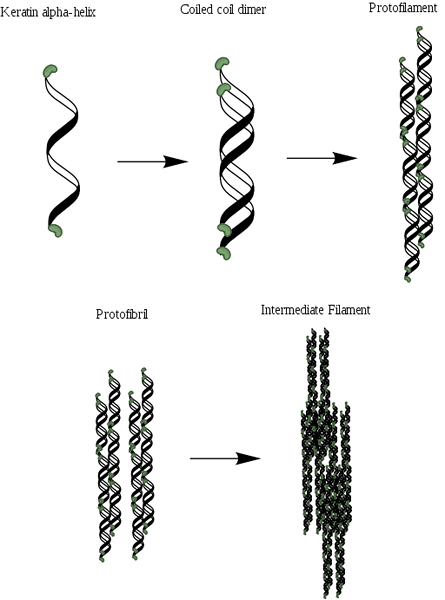
 Alfa-Queratin Organisation Scheme (Bron: MLPatton [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Alfa-Queratin Organisation Scheme (Bron: MLPatton [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Na collageen is het een van de belangrijkste eiwitten van dieren en vertegenwoordigt het het grootste deel van het droge gewicht van het haar, wol, nagels, klauwen en hoeven, veren, hoorns en aanzienlijk deel van de buitenste laag van de huid.
De "keratinised" elementen van dieren kunnen zeer verschillende morfologieën hebben die grotendeels afhankelijk zijn van de functie die ze in elk specifiek organisme uitoefenen.
Keratine is een eiwit dat kenmerken heeft die het een grote mechanische efficiëntie geven in termen van spanning en compressie. Het wordt geproduceerd door een speciaal type cellen die "keratinocyten" worden genoemd, die meestal sterven nadat ze het hebben geproduceerd.
Sommige auteurs bevestigen dat keratines worden uitgedrukt in een stof- en podiumstadion. Bij mensen zijn er meer dan 30 coderende genen voor deze eiwitten en deze behoren tot een familie die is geëvolueerd voor verschillende rondes van genetische duplicatie.
[TOC]
Soorten keratines en hun structuur
Er zijn in wezen twee soorten keratines: α en β. Deze worden onderscheiden door een basisstructuur te bezitten die voornamelijk is samengesteld uit polypeptideketens die kunnen worden ingeschreven als alfa-propellers (α-queratinas) of parallel aan te sluiten als de β-geplooide vellen (β-cheap).
α-queratinas
Dit type keratine is het meest bestudeerd en het is bekend dat zoogdieren ten minste 30 verschillende varianten van dit type keratine hebben. Bij deze dieren maakt α-dat deel uit van nagels, haar, hoorns, helmen, spikes en epidermis.
Net als het collageen bevatten deze eiwitten in hun structuur een overvloedig deel van kleine aminozuren zoals glycine en alanine, die die zijn die de oprichting van alfa propellers mogelijk maken. De moleculaire structuur van een a-queratine bestaat uit drie verschillende gebieden: (1) kristallijne fibrillen of propellers, (2) de terminale domeinen van de filamenten en (3) de matrix.
De propellers zijn twee en vormen een dimeer dat lijkt op een opgerolde spiraal die verenigd blijft dankzij de aanwezigheid van links of disulfur-bruggen (S-S). Elk van de propellers heeft ongeveer 3.6 aminozuurafval in elke beurt die meer of minder 310 aminozuren geeft en bestaat.
Het kan u van dienst zijn: Flora en Fauna van de Ecuadoriaanse Sierra: representatieve soortenDeze opgerolde spiralen kunnen dan worden geassocieerd om een structuur te vormen die bekend staat als protofilament of protofibrilla, die het vermogen heeft om te monteren met anderen van hetzelfde type.
Protofilamenten hebben N- en C-terminals niet-helixeinden die rijk zijn aan cysteïneresten en die zijn bevestigd aan het centrale gebied of matrix. Deze moleculen polymeriseren om de tussenliggende filamenten te vormen met een diameter van bijna 7 nm.
Twee soorten tussenliggende filamenten bestaande uit keratine worden onderscheiden: de tussenliggende zure filamenten (type I) en de basis (type II). Deze zijn ingebed in een eiwitmatrix en de manier waarop deze filamenten worden besteld, beïnvloedt direct de mechanische eigenschappen van de structuur die bestaat.
In type I -filamenten verbinden propellers met elkaar door middel van drie "spiraalvormige connectoren" bekend als L1, L12 en L2 en waarvan wordt gedacht dat het flexibiliteit biedt aan het spiraalvormige domein. In Type II -filamenten zijn er ook twee subdomeinen die een van de spiraalvormige domeinen behoren.
Voorbeeld van een structuur met α-queratinas: haar
Als de structuur van een typisch haar wordt geanalyseerd, heeft deze een geschatte diameter van 20 micron en bestaat uit dode cellen.
 Zoogdierhaar, zoals deze koe, bestaat uit keratine (bron: Frank Winkler via Pixabay.com)
Zoogdierhaar, zoals deze koe, bestaat uit keratine (bron: Frank Winkler via Pixabay.com) Macropibrillen bestaan uit microfibrillen, die minder diameter hebben en met elkaar worden verbonden via een amorfe eiwitstoffen met een hoog zwavelgehalte.
Deze microfibrillen zijn groepen kleinere protofibrillen met een 9+2 organisatiepatroon, wat betekent dat negen protofibrilla's twee centrale protofibrillen omringen; Al deze structuren zijn in wezen samengesteld uit a-queratine.
Zachte keratines en harde keratines
Afhankelijk van het zwavelgehalte dat ze hebben, kunnen α-queratinas worden geclassificeerd als zachte keratines of harde keratines. Dit heeft te maken met de mechanische resistentiekracht die wordt opgelegd door de disulfidebanden in de eiwitstructuur.
In de groep harde keratines zijn die die deel uitmaken van het haar, hoorns en nagels opgenomen, terwijl zachte keratines worden weergegeven door de filamenten die in de huid worden gevonden en calluses.
De disulfidebindingen kunnen worden geëlimineerd door een reductiemiddel toe te passen, dus de structuren bestaande uit keratine zijn niet gemakkelijk verteerbaar door dieren, tenzij ze darmen hebben die rijk zijn aan merchandise, zoals het geval is bij sommige insecten.
Het kan u van dienst zijn: ficologieβ-Queratinas
Β-dat is veel sterker dan α-queratina's en worden gevonden in reptielen en vogels als onderdeel van de klauwen, schubben, veren en pieken. In de gekko's zijn de microvestingen in hun benen (paddestoelen) ook samengesteld uit dit eiwit.
De moleculaire structuur bestaat uit β-peeled vellen gevormd door antiparallete polypeptideketens die samenbinden door bindingen of waterstofbruggen. Deze ketens vormen, naast elkaar, kleine rigide en platte oppervlakken, enigszins gevouwen.
Waar ben je en wat zijn je functies?
De keratinefuncties zijn vooral gerelateerd aan het type structuur dat het bouwt en de plaats van het lichaam van het dier waar het zich bevindt.
Net als andere vezelachtige eiwitten, verleent dit stabiliteit en structurele stijfheid aan de cellen, omdat het behoort tot de grote familie van eiwitten die bekend staat als de familie van tussenliggende filamenten, die eiwitten van het cytoskelet zijn.
In bescherming en dekking
De bovenste laag van de huid van de bovenste dieren heeft een groot netwerk van tussenliggende filamenten gevormd door keratine. Deze laag wordt epidermis genoemd en heeft tussen de 30 micron en 1 nm dik bij mensen.
De epidermis werkt als een beschermende barrière tegen verschillende soorten mechanische en chemische stress en wordt gesynthetiseerd door een speciaal type cellen genaamd "keratinocyten".
Naast de epidermis is er een nog meer externe laag die constant in beweging is.
Espinas en Púas worden ook door verschillende dieren gebruikt voor hun eigen bescherming tegen roofdieren en andere agressors.
Het "pantser" van de pangolines, enkele kleine insectenetende zoogdieren die in Azië en Afrika bewonen, bestaat ook uit "schalen" van keratine die hen beschermen.
In verdediging en andere functies
De hoorns worden waargenomen bij dieren uit de familie Bovidae, dat wil zeggen in koeien, schapen en geiten. Ze zijn zeer sterke en resistente structuren en de dieren die ze hebben als verdediging en verkeringsorganen.
De hoorns worden gevormd door een botcentrum bestaande uit "sponsachtig" bot dat bedekt is met de huid die wordt geprojecteerd uit de achterste zone van de schedel.
 Nagels zijn een ander voorbeeld van lichaamsdelen samengesteld uit keratine (Bron: Adobe Stock via Pixabay.com)
Nagels zijn een ander voorbeeld van lichaamsdelen samengesteld uit keratine (Bron: Adobe Stock via Pixabay.com) De klauwen en nagels, naast hun functies in voedsel en ondersteuning, dienen ook dieren als "wapens" -verdediging tegen aanvallers en roofdieren.
Kan u van dienst zijn: Fixist Theory: Concept, postulates en auteursBird Peaks vervullen verschillende doeleinden, waaronder onder andere voedsel, verdediging, verkering, hitte -uitwisseling en toilet. Meerdere variëteiten van pico's bij vogels worden in de natuur gevonden, vooral in termen van vorm, kleur, grootte en sterkte van de bijbehorende kaken.
De pieken zijn samengesteld, net als de hoorns, door een botcentrum dat wordt geprojecteerd uit de schedel en bedekt is met resistente β-queratinebladen.
De tanden van ongelooflijke dieren ("voorouderlijke" gewervelde dieren) zijn samengesteld uit keratine en hebben, net als de tanden van "superieure" gewervelde dieren, meerdere functies in voedsel en verdediging.
In de beweging
De helmen van vele herkauwers en georiënteerde dieren (paarden, ezels, Alces, enz.) Ze zijn samengesteld uit keratine, ze zijn zeer resistent en ontworpen om de benen te beschermen en samen te werken in de beweging.
De veren, die ook door vogels worden gebruikt om te bewegen, zijn samengesteld uit β-goedkope. Deze structuren hebben bovendien functies in camouflage, in verkering, in thermische isolatie en in onvergankelijkheid.
 De veren en de piek van de vogels zijn ook samengesteld uit keratine (bron: couleur, via Pixabay.com)
De veren en de piek van de vogels zijn ook samengesteld uit keratine (bron: couleur, via Pixabay.com) In de industrie
De textielindustrie is een van de belangrijkste exploitanten van de keratinised structuren, antropocentrisch gesproken. De wol en het haar van veel dieren zijn belangrijk op industrieel niveau, omdat daarmee verschillende kledingstukken die nuttig zijn voor mannen vanuit verschillende gezichtspunten worden vervaardigd.
Referenties
- Koolman, J., & Roehm, k. (2005). Atlas van biochemie kleur (2e ed.)). New York, VS: Thieme.
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biochemie (3e ed.)). San Francisco, Californië: Pearson.
- Nelson, D. L., & Cox, m. M. (2009). Lehninger -principes van biochemie. Omega -edities (5e ed.)).
- Pauling, l., & Corey, r. (1951). De structuur van haar, spieren en gerelateerde eiwitten. Scheikunde, 37, 261-271.
- Phillips, D., Korge, B., & James, W. (1994). Keratine en keratinisatie. Journal of the American Academy of Dermatology, 30(1), 85-102.
- Rouse, J. G., & Dyke, m. EN. Gaan. (2010). Een overzicht van op keratine gebaseerde biomaterialen voor biomedische toepassingen. Materialen, 3, 999-1014.
- Smith, f. J. D. (2003). De moleculaire genetica van keratine -aandoeningen. Am J Clin Dermatol, 4(5), 347-364.
- VOET, D., & Voet, J. (2006). Biochemie (3e ed.)). Pan -Amerikaans medisch redactioneel.
- Wang, B., Yang, W., McKitrick, J., & Meyers, m. NAAR. (2016). Keratine: structuur, mechanische eigenschappen, voorkomen in biologische organismen en inspanningen bij bioinspiratie. Vooruitgang in de materiële wetenschap.
- « Nieuwe Spanje en relaties met de wereldachtergrond, routes
- Herhalingskenmerken van herhaling, voordelen, nadelen »

