Oxidasetest fundering, procedure en gebruik
- 1650
- 162
- Dr. Rickey Hudson
De oxidasetest Het is een diagnostische methode die de aanwezigheid toont van het enzymatische complex genaamd cytochrome oxidase C. Dit systeem induceert de transformatie van het gereduceerde tot geoxideerde cytochroom, omdat het zuurstof vangt en dit op zijn beurt werkt als de laatste elektronenacceptor (h (h+) In de ademhalingsketen.
De oxidase -term is een samenvattende manier om te verwijzen naar het cytochroomoxidase -enzym, ook bekend als oxidase -indefenol. In de oudheid werd aangenomen dat cytochroomoxidase en indefenoloxidase -enzymen twee verschillende enzymen waren, maar vandaag is het bekend dat ze hetzelfde zijn.
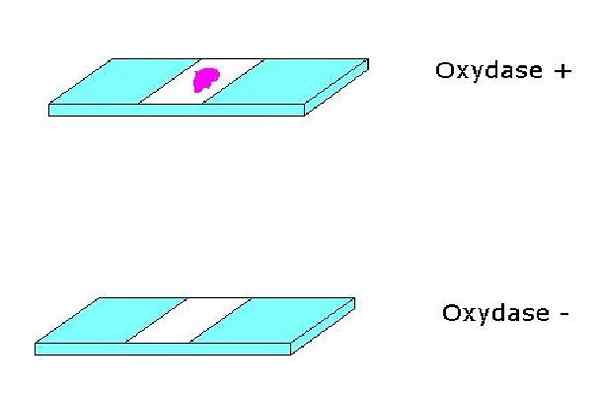
 Positieve en negatieve oxidasetest. Bron: Geen machine-leesbare auteur verstrekt. Alfa.Prim ~ commonswiki verondersteld (op basis van auteursrechtclaims). [Publiek domein]
Positieve en negatieve oxidasetest. Bron: Geen machine-leesbare auteur verstrekt. Alfa.Prim ~ commonswiki verondersteld (op basis van auteursrechtclaims). [Publiek domein] Van hun kant zijn cytochromen hemoproteïnen die ijzer bevatten en het cytochroomoxidasesysteem voltooien. Cytochromen kunnen van de ene soort tot de andere variëren.
Er zijn verschillende soorten cytochromen (cytochromen A1, A2, A3 en 0). Sommige bacteriën kunnen er maar één produceren, maar andere tot twee of drie tegelijkertijd. In deze zin staat de aanwezigheid van cytochroom A en A3 bekend als cytochroom - oxidase C. Dit is het type cytochroom dat de oxidasetest detecteert.
De genres van Neisseria en Pseudomonas bevatten oxidase C cytocrome. Deze genres geven de positieve oxidasetest, waardoor ze differentiëren van respectievelijk de Acinetobacter en Stenotrophomonas -genres.
Er zijn ook andere genres die positief oxidase zijn.
[TOC]
Basis
Kenmerken van het cytochroom oxidasesysteem C
Het oxidase cychocroma -systeem C werkt als volgt: positieve oxidase -micro -organismen gebruiken zuurstof om energie te genereren door aerobe ademhaling. Dit systeem werkt dankzij het transport van elektronen uit donorstoffen zoals NADH+ Naar het ontvangen van stoffen, in dit geval zuurstof.
Dit resulteert in energie (ATP) en waterperoxide, afhankelijk van het oxidase -cytochroomsysteem dat de micro -organisme bezit.
Dat is de reden waarom de meeste positieve oxidase -bacteriën ook een positieve catalase zijn, een noodzakelijke voorwaarde om geproduceerde waterstofperoxide te elimineren, omdat deze stof giftig is voor bacteriën.
Het oxidase C cytocrome systeem is aanwezig in sommige aerobe bacteriën, bepaalde optionele anaërobe, schaarse micro -overbodig en geen strikt anaërobe. De laatste is begrijpelijk, omdat strikte anaëroben niet kunnen leven in aanwezigheid van zuurstof, daarom missen ze het cytochroom oxidasesysteem.
Bewijsprincipe
Gebruik in dit teststoffen die fungeren als kunstmatige elektronenacceptoren, ter vervanging van de inboorlingen in de elektronentransportketen.
Voornamelijk kleurstoffen zoals parafenylendiamine en indophenol worden gebruikt, die fungeren als receptorsubstraten en kunstmatige elektronendonoren.
Parafenyndiamine wordt geoxideerd door het cytocrome oxidase C -systeem. De kleurstof in zijn gereduceerde vorm is kleurloos, maar in zijn geoxideerde vorm is het gekleurd.
Dit is hoe de aanwezigheid van het cytochroom oxidase C -systeem C; Welnu, een positieve reactie zal een lavendel of blauwe kleuring genereren -Púrpura, afhankelijk van het gebruikte reagens.
Kan u dienen: paleobiologie: geschiedenis, specialiteiten, ontdekkingenAan de andere kant, als de laatste elektronenacceptorstof in de ademhalingsketen verschilt van zuurstof, zal de oxidasetest negatief geven (er is geen kleurproductie); Dit is het geval van anaërobe micro -organismen.
Evenzo, als het cytochroom dat door het micro -organisme wordt gebruikt, verschilt van de cytochroomoxidase C, zal het ook de negatieve test geven.
Procedure
Voor de oxidasetest zijn er verschillende reagentia en protocollen, allemaal met hetzelfde doel.
Reagentia
Kovacs Reactive, Gordon en McLeod Reagent, Nadi -reagens, timmermanagens, Suhrland en Morrison, en gebruik van oxidase -schijven.
-Kovacs oxidase -reagens
Het bestaat uit tetramethyl-p-fenylendiamine dichloorhydraat bij 1%.
Het Kovacs -reagens wordt bereid door 1 gr van de stof op te lossen die wordt genoemd in 50 ml gedestilleerd water. Het wordt subtiel verwarmd tot de totale oplossing. Breng over in een barnsteenfles van voldoende capaciteit en voltooi het volume op 100 ml met gedestilleerd water. Wacht minstens 15 minuten voordat u gebruikt. Opslaan in koelkast beschermd tegen licht.
Het wordt gedraaid als een kovacs -oxidase -reagens, om het te onderscheiden van het kovacs -reagens dat wordt gebruikt om de indoltest te onthullen. Dit reagens is het meest gevoelige, minder giftige maar duurder dan de rest van de reagentia.
Een positieve reactie zal bewijs zijn. Er wordt een negatieve reactie bewezen omdat er geen kleurverandering is in de kolonie of er een lichte roze kleuring voor nodig is. Het medium kan ook donker worden, maar dat betekent niet positieve reactie.
Met dit reagens is de reactietijd cruciaal, die kleurverandering die optreedt tussen 5 en 15 sec wordt beschouwd als een positieve reactie.
-Gordon en McLeod -reagens
Het is samengesteld uit dichloorhydraat met dimethyl-p-fenylendiamine, ook bekend als N-dimethyl-p-fenylendiamine of p-amynodimethylaniline p-amocorhydraat. Het wordt bereid zoals beschreven voor het oxidase -reagens van Kovacs, ter vervanging van de betrokken stof.
Dit reagens is iets stabieler dan het oxidase-reagens van Kovacs, hoewel alle reagentia die P-penilendiamine bevatten onstabiel zijn.
Deze reactie is laat.
-Nadi -reagens
Het bestaat uit 1% α-naftol in ethylalcohol (95% ethanol) en 1% amin-limanyline. Het mengsel wordt in gelijke delen bereid en het gebruik van absolute ethylalcohol als een dilient, totdat de voldoende hoeveelheid is voltooid gedurende 100 ml.
-Carpenter Reactive, Suhrland en Morrison
Het bestaat uit 1% p-amynodimethylalanine-oxalaat. Bereid op dezelfde manier voor die beschreven voor Kovacs -oxidase -reagens, verandert voor de bijbehorende stof.
Kan je van dienst zijn: voedselketen van de jungleMet de oplossing gereed, worden reactieve strips als volgt bereid: Whatman 6-8 cm nummer 1.
Ze mogen drogen zonder contact te hebben met metaal, op te slaan in pottendraad met droogmiddel en bewaar in de koelkast. Deze strips zijn maximaal 6 maanden stabiel.
Het is het meest stabiele reagens van alle genoemde, in staat zijn om tot 6 maanden in oplossing te gaan. Een ander punt in het voordeel is dat het medium niet rond de kolonie kleurt, als het direct op de plaat wordt gebruikt.
Het uiterlijk van een rode kleur wordt geïnterpreteerd als een positieve test.
-Oxidase schijven
Het zijn commerciële schijven die worden geïmpregneerd met reagens voor oxidasetest. Er zijn verschillende commerciële merken op de markt.
Het gebruik ervan is vrij praktisch, omdat we geen verse reagentia moeten voorbereiden, wat werk vergemakkelijkt. De verkregen resultaten zijn betrouwbaar zolang de schijven correct worden bewaard.
Protocollen
Directe plaatmethode, indirecte methode op papier en gebruik van geïmpregneerde schijven met oxidase -reagentia.
-Directe plaatmethode
2 of 3 druppels van een van de bovengenoemde reagentia worden voor dit doel rechtstreeks toegevoegd op de kolonie (en) in een kweekmediumplaat die geen glucose bevat.
De verandering of niet de kleur van de koloniën wordt geïnterpreteerd, niet het medium. De geldige reactietijd hangt af van het gebruikte reagens.
-Indirecte methode op papier
Knip een stuk filterpapier (Whatman n ° 1) tot een grootte van 6 cm2 En het wordt in een lege petri geplaatst.
Voeg 2 of 3 druppels van het oxidase -reagens van Kovacs toe op papier, neem deel aan de kolonie die u wilt bestuderen met een platinakhandel of houten stok en breidt het uit in een rechte lijn op het geïmpregneerde reagenspapier. Interpreteer in een periode van 5 tot 10 seconden.
Met de strips bereid met de timmerman, strekt Suhrland en Morrison -reagens een kolonie uit op de droge strip. Dezelfde strip dient om verschillende stammen te proberen. Interpreteren op 10 sec.
-Schijven (mdirecte ethod)
Subtiel bevochtig commerciële schijven met steriel gedestilleerd water en overwonnen de kolonie om te studeren. Het wordt aanbevolen om de platen bij 35 ° C te gebruiken, als platen worden gebruikt bij kamertemperatuur of gekoelde platen, de reactie is een beetje langzamer. Interpreteer de kleurverandering tussen 10 en 20 seconden.
Kolonies in bloed of chocolade kunnen worden gebruikt.
-Schijven (indirecte methode)
Bevochtig het album zoals hierboven beschreven. Plaats het op een lege petri. Neem voldoende hoeveelheid van de kolonie om te studeren met een platinakend of houten stok en plaats op de schijf. Interpreteer de kleurverandering tussen 10 en 20 seconden.
Gebruik
Het geslacht Neisseria en Acinetobacter lijken soms op veel morfologisch op veel morfologisch omdat hoewel het Acinetobacter -genre een gram negatieve bacil is, soms een kokoidvorm kan aannemen en in paren kan distribueren, waardoor het geslacht Neisseria simuleert,.
Kan u van dienst zijn: limnologieIn dit geval is de oxidasetest echt nuttig. Het geslacht Neisseria is positief en negatief Acinetobacter.
Het geslacht Moraxella lijkt echter erg op het geslacht Neisseria en geven beide een positieve reactie; Daarom moeten we altijd koolhydraatfermentatietests uitvoeren voor definitieve identificatie.
Aan de andere kant is de oxidasetest nuttig voor het differentiëren van een bacterie die behoort tot de Enterobacteriaceae -familie (alle negatieve oxidase) van andere fermers, zoals het pasturel -geslacht, aeromonen, Plesiomonas (positieve oxidase).
Het geslacht Vibrio en Helicobacter zijn ook positief oxidase.
QA
Gebruik bekende stammen van Escherichia coli als negatieve controle en spanningen van Pseudomonas aeruginosa als positieve controle.
Beperkingen
-Reagentia moeten vers worden gebruikt, hun nuttige levensduur in kamertemperatuur is kort om zeer onstabiel te zijn. Gekoeld kan tussen 5 dagen tot 2 weken duren.
-De reagentia zijn kleurloos, als ze van kleur veranderen, moeten ze worden weggegooid. Beschadigde schijven zijn duidelijk omdat ze na verloop van tijd donker worden.
-Een positieve reactie met het oxidase -reagens van kovacs tussen 15-60 sec wordt beschouwd als een vertraagde reactie en na 60 seconden moet het als negatief worden beschouwd.
-Hij Hemophylus influenzae Het geeft een negatieve oxidase-reactie als een reagens met dimethyl-p-fenylendiamine wordt gebruikt, maar positief als het oxidasereagens van kovacs (tetramethyl-p-fenylendiamine) nuttig wordt gebruikt).
-Media die glucose bevatten interfereren in de test, vals negatief.
-De stammen van Bordetella pertussis Ze kunnen vals positieve reactie geven als ze uit zeer geconcentreerde bloedagarplaten komen.
-Het gebruik van metalen handgrepen (ijzer) geeft een vals positieve reactie.
aanbevelingen
-Omdat de reagentia erg onstabiel zijn en de neiging hebben zichzelf te doen.
-Een andere manier om het zelf-outlet van het reagens uit te stellen, is door 0,1% ascorbinezuur toe te voegen op het moment van het bereiden van reagentia.
-Omdat reagentia onstabiel zijn, wordt het aanbevolen om wekelijkse kwaliteitscontrole uit te voeren.
-Reagentia die niet slagen, mogen de kwaliteitscontroletest niet worden gebruikt.
Referenties
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. 5e ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.
- Forbes B, Sahm D, Weissfeld a. (2009). Bailey & Scott microbiologische diagnose. 12 ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.
- "Oxidasetest." Wikipedia, gratis encyclopedie. Jan 2018, 10:32 UTC. Apr 2019, 14:03
- Wereldgezondheidsorganisatie. Laboratoriumhandleiding voor de identificatie en test van gevoeligheid voor antimicrobiërs van bacteriële ziekteverwekkers van belang voor de volksgezondheid in de ontwikkelingswereld.2004. Beschikbaar bij: wie.Int/DrugSistance/Infoshing
- Reactieve strips voor de diagnose van oxidase -activiteit bij bacteriën. Cubaanse rev. 2000; 52 (2): 150-151.

