Catalase Test Foundation, Techniek en gebruik

- 1209
- 152
- Miss Herman Russel
De catalase Het is een methodologie die wordt gebruikt in bacteriologielaboratoria om de aanwezigheid van enzymcatalase te benadrukken in die bacteriën die het bezitten. Naast de kleuring van Gram zijn de belangrijkste tests die moeten worden uitgevoerd op vers geïsoleerde micro -organismen. Deze tests leiden de microbioloog over de te volgen stappen voor de definitieve identificatie van het betreffende micro -organisme.
Over het algemeen hebben bacteriën die cytochroom bevatten het catlase -enzym, dat wil zeggen aerobe en optionele anaërobe bacteriën moeten het bezitten. Er zijn echter uitzonderingen, zoals Streptococcus, die ondanks optionele anaërobe micro -organismen niet het catalase -enzym bezitten.
 Uitvoering van de catalasetest, die een positieve reactie vertoont. Bron: Geen machine-leesbare auteur verstrekt. Nase verondersteld (op basis van auteursrechtclaims). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]
Uitvoering van de catalasetest, die een positieve reactie vertoont. Bron: Geen machine-leesbare auteur verstrekt. Nase verondersteld (op basis van auteursrechtclaims). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]] Daarom wordt de catalasetest voornamelijk gebruikt om Staphylococaee en Micrococaceae (beide positieve catalase) van de Streptococaee -familie (negatieve catalase) (negatieve catalase) te onderscheiden.
Evenzo wordt het geslacht Bacillus (positieve catalase) onderscheiden van onder andere het geslacht Clostridium (negatieve catalase).
[TOC]
Basis
Catalase is een enzym geclassificeerd als een hydroperoxidase, dit betekent dat ze waterstofperoxide als een substraat gebruiken (h2OF2)).
Het wordt ook beschouwd als een oxidoreductase, omdat er in de reactie een element is dat dient als een donor van elektronen (reducerende substantie) en een andere als een elektronenontvanger (oxiderende substantie).
Catalase is een eiwit dat een prostorische groep bevat met vier drievoudige ijzeratomen (geloof+++), daarom is het een homoproteïne. Het ijzerion blijft geoxideerd tijdens de reactie.
Men kan zeggen dat catalase een ontgiftend enzym is, omdat de functie ervan is om stoffen te elimineren die optreden tijdens bacteriemetabolisme die giftig zijn voor bacteriën. Onder deze stoffen is waterstofperoxide.
Waterstofperoxide wordt gevormd uit de ontleding van suikers door aerobics. Dit proces vindt plaats als volgt:
Het superoxide -ion (of2-) (Vrij radicaal) wordt gevormd als een eindproduct van de assimilatie van glucose door aerobe weg. Dit is giftig en wordt geëlimineerd door de enzym -superoxidedysmutase die het transformeert in gasvormige zuurstof en waterstofperoxide.
Het kan je van dienst zijn: Holdridge Life Zones: wat is in Latijns -AmerikaWaterstofperoxide is ook giftig voor bacteriën en moet worden geëlimineerd. Het catalase -enzym ontvouwt waterstofperoxide in water en zuurstof.
Catalase kan werken op andere substraten anders dan waterstofperoxide, zoals alcoholen, aldehyden, zuren, aromatische amines en fenolen. Waterstofperoxide kan echter ook worden gebruikt door catalase om andere toxische verbindingen zoals methyl en ethylalcohol te oxideren.
Evenzo is catalase aanwezig in fagocytische cellen, waardoor het wordt beschermd tegen de toxische werking van waterstofperoxide.
Routinematige techniek voor catalasetest
-Methode in de dia
Materialen
3% waterstofperoxide (10 volumes).
Draagbare lamina
Wegwerp plastic handvat of houten stok.
Procedure
Neem voldoende hoeveelheid uit de kolonie om te studeren zonder de agar aan te raken waaruit deze vandaan komt. De kolonie moet vers zijn, dat wil zeggen van een oogst van 18 tot 24 uur.
Plaats de kolonie op de droge houder en voeg er een druppel van 3% waterstofperoxide toe (u kunt ook H gebruiken2OF2 bij 30%). Observeer onmiddellijk als bubbels loskomen of niet.
Interpretatie
Positieve reactie: gasdetachement, wat duidelijk is bij de vorming van bubbels (sterke bel).
Negatieve reactie: er is geen bellenvorming.
-Directe methode in pure cultuur
Plaats 1 ml H H2OF2 3% op zuiver gewas in platen of wiggen die geen bloed bevatten (bij voorkeur voedzame grip). Observeer of er al dan niet onmiddellijk bellenvorming is. Je kunt ook h gebruiken2OF2 30%.
Het wordt geïnterpreteerd, net als de methode voor objecthouder.
-Methode met capillaire of fung- en Petrishko -buis
Vul een capillaire buis van 67 mm op een hoogte van 20 mm met 3% waterstofperoxide per capillariteit.
Raak de geïsoleerde kolonie aan die je wilt studeren met de capillair vol h2OF2 3%. Observeer of het capillair is gevuld met bubbels in ongeveer 10 seconden. Deze methode maakt het mogelijk om de reactie op kruisen semi-kwantificeren:
Zonder kruisen zijn er geen bubbels (negatieve reactie).
Kan u dienen: Flora en Fauna van de Falkland -eilanden: uitstekende soorten+ --Schaarse bubbels (zwakke of vertraagde reactie).
++ -Overvloedige bubbels (matige reactie).
+++ -Bubbels bereiken het tegenovergestelde uiteinde (energetische reactie).
-Taylor en Achanzar -methode voor catalasetests die twijfelachtig geven
Plaats in een schone en droge dia een geïsoleerde kolonie en plaats dan een druppel h2OF2 0,5% en dek af met een deksel. Observeer of er al dan niet een vorming van gevangen bubbels is.
Interpretatie: de aanwezigheid van bubbels duidt op een positieve reactie. Zonder bubbels wordt het geïnterpreteerd als een negatieve reactie.
Catalasetest voor Mycobacterium -soorten
Deze techniek moet worden gedaan door de pH en temperatuur te regelen. Het moet worden uitgevoerd onder een laminaire stroombel, omdat de manipulatie van de verschillende soorten Mycobacterium gevaarlijk is.
-Materialen
30% of 110 volume waterstofperoxide (superoxaal).
Fosfaatbuffer pH 7
Tween 80 tot 10%
Mycobacterium -cultuur in wig van 3 tot 4 weken
-Voorbereiding van reagentia
Fosfaatbuffer pH 7
Wegen:
1,361 g van (KH2Po4) Anhydra.
1.420 g (Na2HPO3) dysodisch fosfaat watervrij.
Los beide zouten op in een beetje steriel gedestilleerd water en compleet met water tot 1000 ml.
Tween 80 tot 10%
Voer een 1:10 verdunning uit voor de Tween 80 die commercieel geconcentreerd wordt, zodat dit als volgt zou gaan:
Neem 1 ml Tween 80 en plaats het in een beetje gedestilleerd water, lost op en voltooi het volume met water tot 10 ml.
Laatste reagens
Meng een hoeveelheid fosfaatbuffer met een hoeveelheid tween 80 tot 10% (in gelijke delen). Definieer in het laboratorium hoeveel u wilt voorbereiden.
-Procedure
Plaats 5 ml fosfaatbuffer in een steriele testbuis met draaddeksel (Baquelita).
Neem met een inoculatiehendel voldoende kolonie van een groei van een Mycobacterium gezaaid in wiggen en lost op in de fosfaatbuffer.
Bedek de buis zonder de draad aan te spannen. Plaats 20 tot 30 minuten in een badkamer op 68 ° C. Uithalen en afkoelen op 22-25 ° C
Meet 0,5 ml van het uiteindelijke reagens (mengsel) en voeg het toe aan de buis met de koude oplossing. Observeer of geen bubbelvorming.
Het wordt zowel geïnterpreteerd als de vorige technieken.
Gebruik
Wanneer een groei van kolonies in verrijkte media wordt verkregen, moeten een gramkleuring en een catalasetest worden uitgevoerd naar de verkregen kolonies. Dit zal de microbioloog begeleiden over de procedures die moeten worden gevolgd voor definitieve identificatie.
Kan u van dienst zijn: eenvoudig plat epitheel: kenmerken, functies en typen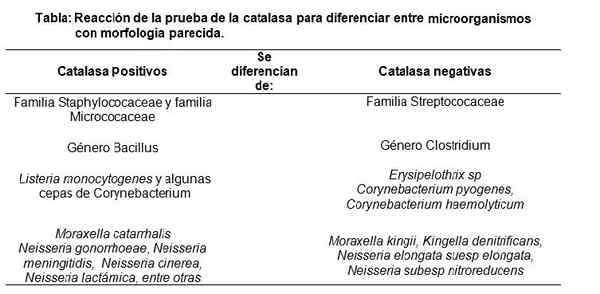 Bron: Opgesteld door auteur MSC. Marielsa Gil
Bron: Opgesteld door auteur MSC. Marielsa Gil QA
Gebruik vers gecultiveerde controles, zoals om de juiste werking van het waterstofperoxide -reoxide -reagens te evalueren, zoals Staphylococcus aureus als positieve controle en spanningen van Streptococcus SP Als negatieve controle.
Een ander alternatief dat dient als een positieve controle is om een druppel waterstofperoxide op bloedagar te plaatsen, erytrocyten hebben een catalase, daarom zal er een borrelen zijn als het reagens in goede staat is.
U kunt een chocolade -agar gebruiken als een negatieve controle, hier zijn de erytrocyten al vermeld en de test geeft negatief.
Beperkingen
-Gebruik geen oude gewassen voor de test, omdat dit valse negatieven kan veroorzaken.
-Neem geen kolonies uit gewassen in bloedagar, als u voorzichtig bent om de agar niet aan te raken; Deze procedure kan valse positieven veroorzaken, omdat erytrocyten catalase bevatten.
-Als u de kolonie met platina -handgreep neemt, investeer dan niet de volgorde van de procedure omdat dit valse positieven kan genereren. Dit komt omdat platina in staat is om te reageren met waterstofperoxide, afkomstig uit een bubbel.
-Gebruik het waterstofperoxide -reagens niet als het erg oud is, omdat het reagens erg onstabiel is en de neiging heeft om in de loop van de tijd af te breken.
-Houd het reagens van waterstofperoxide beschermd tegen licht en koeling om schade te voorkomen.
-Voer kwaliteitscontrole uit naar het waterstofperoxide -reagens telkens wanneer het wordt gebruikt.
-Houd er rekening mee dat als H wordt gebruikt2OF2 Bij 30% zijn de reacties sterker dan die welke worden uitgevoerd met h2OF2 3%.
Referenties
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. 5e ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.
- Forbes B, Sahm D, Weissfeld a. (2009). Bailey & Scott microbiologische diagnose. 12 ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.
- Mac Faddin J. (2003). Biochemische tests voor de identificatie van klinisch belang bacteriën. 3e ed. Pan -Amerikaans redactioneel. Buenos Aires. Argentinië.
- BD Laboratories. Catalase -reagens. Beschikbaar op: http: // winklerltda.Klet
- Vadequímica Laboratories. Waterstof peroxide. Gelijkwaardigheid tussen volumes en percentage. Beschikbaar op: vadequimica.com
- « Complementaire gebeurtenissen wat ze bestaan en voorbeelden
- JOSEP Carner Biography, Style and Works »

