Periodieke eigenschappen van de elementen en hun kenmerken

- 4194
- 658
- Pete Heaney V
De Periodieke eigenschappen van de elementen Zij zijn degenen die hun fysische en chemische gedrag definiëren vanuit een atomair perspectief, en wiens magnitudes, naast het atoomnummer, een classificatie van atomen toestaan.
Van alle eigenschappen worden deze gekenmerkt, zoals de naam al aangeeft, omdat ze periodiek zijn; Dat wil zeggen, als het periodiek systeem wordt bestudeerd, kan worden gecertificeerd dat zijn grootte een trend gehoorzamen die samenvalt en herhaalt met de bestelling van de elementen in perioden (rijen) en groepen (kolommen).
 Intrinsieke periodiciteit van een deel van de elementen van het periodiek systeem. Bron: Gabriel Bolívar.
Intrinsieke periodiciteit van een deel van de elementen van het periodiek systeem. Bron: Gabriel Bolívar. Als u bijvoorbeeld een periodieke periode aflegt en de eigendom met elk element met grootte afneemt, zal in alle perioden hetzelfde plaatsvinden. Aan de andere kant, als het een groep of kolom uitvoert, verhoogt het de omvang ervan, hetzelfde kan worden verwacht voor de andere groepen.
En dus worden hun variaties herhaald en bewezen een eenvoudige trend die overeenkomt met het ordenen van de elementen voor hun atoomnummers. Deze eigenschappen zijn rechtstreeks verantwoordelijk voor de metalen of niet -metalen aard van de elementen, evenals hun reactiviteiten, die hen hebben geholpen met een grotere diepte.
Als de identiteit van de elementen voor een moment onbekend was en ze werden gezien als vreemde "bollen", zou het periodiek systeem kunnen worden herbouwd (met veel werk) die deze eigenschappen gebruiken.
Op deze manier zouden de veronderstelde bollen kleuren verwerven waarmee ze ze in groepen van elkaar kunnen onderscheiden (superieure afbeelding). Als ze hun elektronische kenmerken kennen, konden ze zich in periodes organiseren en de groepen zouden degenen die hetzelfde aantal valentie -elektronen hebben verraden.
Leren en redeneren periodieke eigenschappen is gelijk om te weten waarom de elementen op de een of andere manier reageren; Het is wetende waarom de metalen elementen zich in bepaalde gebieden van de tafel bevinden, en de niet -metalen elementen in een andere.
[TOC]
Wat zijn de periodieke eigenschappen en hun kenmerken
-Atomaire radio
Bij het observeren van het beeldbollen is het eerste dat kan worden opgemerkt, is dat niet allemaal dezelfde grootte is. Sommige zijn meer omvangrijk dan andere. Als het met meer detail wordt waargenomen, zal blijken dat deze maten variëren die een patroon hoorzamen: in een periode neemt het van links naar rechts af en neemt in een groep van boven naar beneden toe van boven naar beneden.
Het bovenstaande kan ook op deze manier worden gezegd: de atomaire straal neemt af naar de groepen of kolommen van rechts en neemt toe in de lagere periodes of rijen. De atomaire straal is dus de eerste periodieke eigenschap, omdat de variaties ervan een patroon binnen de elementen volgen.
Nucleaire belasting versus elektronen
Wat is dit patroon? In een periode bezetten de atoomelektronen hetzelfde energieniveau, dat gerelateerd is aan de afstand die hen van de kern scheidt. Wanneer we van de ene groep naar de andere gaan (wat hetzelfde is als de periode naar rechts reizen), voegt de kern zowel elektronen als protonen toe binnen hetzelfde energieniveau.
Kan u van dienst zijn: koolstofDaarom kunnen elektronen geen afstanden bezetten van de kern, die zijn positieve belasting verhoogt omdat het meer protonen heeft. Bijgevolg ervaren elektronen een grotere aantrekkingskracht naar de kern, waardoor ze steeds meer aantrekken naarmate het aantal protonen toeneemt.
Dat is de reden waarom de elementen aan de rechterkant van de periodiek systeem (gele en turquoise kolommen) kleinere atoomradio's hebben.
Aan de andere kant, wanneer "springt" van de ene periode naar de andere (wat hetzelfde is om te zeggen dat een groep afdaalt), laten de nieuwe ingeschakelde energieniveaus elektronen in staat om meer verre ruimtes in de kern te bezetten. Als je verder bent, trekt de kern (met meer protonen) ze met minder kracht aan; En atomaire radio's nemen daarom toe.
Ionische radio's
Ionische radio's gehoorzamen een patroon vergelijkbaar met dat van atomaire radio's; Deze hangen echter niet zozeer af van de kern, maar hoeveel elektronen of minder hebben het atoom ten opzichte van de neutrale toestand.
Kationen (NA+, AC2+, Naar de3+, Zijn2+, Vertrouwen3+) vertonen een positieve belasting omdat ze een of meer elektronen hebben verloren, en daarom trekt de kern ze met grotere kracht aan, omdat er minder afstotingen tussen hen zijn. Het resultaat: kationen zijn kleiner dan de atomen waaruit ze afleiden.
En voor anionen (of2-, F-, S2-, Je-) Integendeel, ze vertonen een negatieve belasting omdat het een of meer overtollige elektronen heeft, waardoor zijn afstotingen met elkaar worden vergroot boven de aantrekkingskracht die de kern uitoefent. Het resultaat: de anionen zijn groter dan de atomen waaruit ze afleiden (lager beeld).
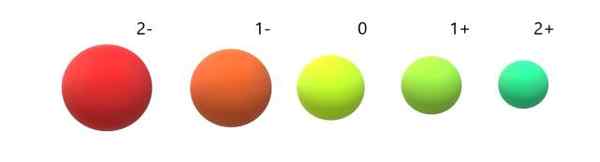 Variatie van ionische radio's ten opzichte van het neutrale atoom. Bron: Gabriel Bolívar.
Variatie van ionische radio's ten opzichte van het neutrale atoom. Bron: Gabriel Bolívar. Het is te zien dat anion 2- het meest omvangrijke van allemaal is, en het kation 2+ de kleinste. Radio's nemen toe wanneer het atoom negatief wordt opgeladen en samentrekt wanneer het positief wordt opgeladen.
-Elektronegativiteit
Wanneer de elementen kleine atoomradio's hebben, worden niet alleen hun elektronen sterk aangetrokken, maar ook de elektronen van aangrenzende atomen wanneer het een chemische binding vormt. Deze neiging om de elektronen van andere atomen binnen een verbinding aan te trekken, is wat bekend staat als elektronegativiteit.
Degene die een atoom klein is, betekent niet dat het meer elektronegatief zal zijn. Als dat zo is, zouden helium- en waterstofelementen de meest elektronegatieve atomen zijn. Helium tot waar de wetenschap heeft aangetoond, vormt geen covalente link van welke aard dan ook; En waterstof heeft nauwelijks een enkel proton in de kern.
Kan u van dienst zijn: kopersulfide: structuur, eigenschappen, gebruikWanneer atomaire radio's groot zijn, hebben de kernen niet genoeg sterkte om de elektronen van andere atomen aan te trekken; Daarom zijn de meest elektronegatieve elementen die met een kleine atoomradius en een groter aantal protonen.
Nogmaals, degenen die deze kenmerken perfect ontmoeten, zijn de niet -metalen elementen van het P -blok van het periodiek systeem; Dit zijn die behoren tot groep 16 of zuurstof (O, S, SE, TE, PO) en groep 17 of fluor (F, Cl, Br, I, AT).
Trend
Volgens alles wat gezegd is, bevinden de meeste elektronegatieve elementen zich vooral in de rechterbovenhoek van het periodiek systeem; Fluoride hebben als het element dat de lijst van de meest elektronegatieve leidt.
Omdat? Zonder toevlucht te nemen tot elektronegativiteitsschalen (Pauling, Mulliken, etc.), de fluor, hoewel het groter is dan de neon (het edelgas van zijn periode), kan de eerste links vormen, terwijl de tweede niet doet. Bovendien heeft de kern voor zijn kleine omvang veel protonen, en waar de fluor is, zal er een dipoolmoment zijn.
-Metaalkarakter
Als een element een atomaire straal heeft in vergelijking met die van dezelfde periode, en ook weinig elektronegatief is, is het dan een metaal en heeft het een hoog metaalkarakter.
Als we terugkeren naar de hoofdafbeelding, komen de roodachtige en groenachtige bollen, net als de grijs, overeen met metalen elementen. Metalen hebben unieke kenmerken, en vanaf hier beginnen de periodieke eigenschappen met de fysieke en macroscopische eigenschappen van materie met elkaar verweven te zijn.
De elementen met een hoog metaalkarakter worden gekenmerkt door hun relatief grote atomen, gemakkelijk om elektronen te verliezen, omdat de kernen ze nauwelijks naar hen kunnen aantrekken.
Als gevolg hiervan oxideren of verliezen ze gemakkelijk elektronen om kationen te vormen, m+; Dit betekent niet dat alle kationen metaalachtig zijn.
Trend
Op dit punt kunt u voorspellen hoe het metaalkarakter in de periodieke tabel varieert. Als het bekend is dat metalen grote metalen radio's hebben en dat er ook weinig elektronegatieven zijn, moeten de zwaarste elementen (lagere periodes) worden verwacht, het meest metaalachtig zijn; en de lichtere elementen (de bovenste periodes), de minst metallic.
Evenzo vermindert het metalen karakter, hoe meer elektronegatief het element wordt gemaakt. Dit betekent dat het toeren van de periodes en groepen rechts van het periodiek systeem, in hun hogere periodes, zal voldoen aan de minste metalen elementen.
Daarom neemt het metalen karakter toe door af te dalen door een groep en neemt het af tot recht in dezelfde periode. Onder de metaalelementen die we hebben: NA (natrium), Li (lithium), Mg (magnesium), BA (barium), Ag (zilver), Au (goud), PO (Polonio), PB (lood), CD (Cadmium (Cadmium (Cadmium (Cadmium (Cadmium ), Tot (aluminium), enz.
Kan u van dienst zijn: kookpunt: concept, berekening en voorbeelden-Ionisatieenergie
Als een atoom een grote atoomradius heeft, wordt verwacht dat zijn kern de elektronen niet in aanzienlijke sterkte in de buitenste lagen houdt. Bijgevolg zal het elimineren van ze uit het atoom in een gasfase (geïndividualiseerd) niet veel energie vereisen; Dit is, ionisatie -energie, EI, noodzakelijk om een elektron weg te nemen.
Het is ook gelijk aan te zeggen dat het de energie is die moet worden geleverd om de aantrekkingskracht van de kern van een atoom of gasion op zijn buitenste elektron te overwinnen. Hoe kleiner het atoom en meer elektronegatief, hoe lager het is; Dit is uw neiging.
De volgende vergelijking illustreert een voorbeeld:
Na (g) => na+(g) + e-
De nodige om dit te bereiken is niet zo groot in vergelijking met de tweede ionisatie:
NA+(g) => na2+(g) + e-
Sinds in NA+ Positieve ladingen overheersen en het ion is kleiner dan het neutrale atoom. Bijgevolg de kern van Na+ trekt aan met een veel grotere kracht voor elektronen, dus het vereist een veel grotere.
-Elektronische affiniteit
En ten slotte is er het periodieke eigendom van elektronische affiniteit. Dit is de energietrend die het atoom heeft van een gasfase -element voor het accepteren van een elektron. Als het atoom klein is en een kern heeft met een grote aantrekkingskracht, is het gemakkelijk voor u om het elektron te accepteren, waardoor een stabiel anion wordt gevormd.
Hoe stabieler het anion ten opzichte van zijn neutrale atoom, hoe groter zijn elektronische affiniteit. Afstotingen tussen dezelfde elektronen komen echter ook in het spel.
Stikstof heeft bijvoorbeeld een grotere elektronische affiniteit dan zuurstof. Dit komt omdat hun drie elektronen 2p verdwenen zijn en minder met elkaar en het inkomende elektron afstoten; In zuurstof zijn er een paar gepaarde elektronen die een grotere elektronische afstoting uitoefenen; En in de fluoride zijn er twee paren.
Het is om deze reden dat de trend in elektronische affiniteiten wordt genormaliseerd vanaf de derde periode van het periodiek systeem.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Profit. Ortega Graciela M. (1 april 2014). Periodieke eigenschappen van de elementen. ABC -kleur. Opgehaald uit: ABC.com.Py
- Chemistry Libhethexts. (7 juni 2017). Periode eigenschappen van de elementen. Hersteld van: chem.Librhetxts.borg
- Helmestine, Anne Marie, pH.D. (2 januari 2019). De periodieke eigenschappen van de elementen. Hersteld van: Thoughtco.com
- Toppr. (S.F.)). Periode eigenschappen van elementen. Hersteld van: toppr.com /
- Periodieke eigenschappen van de elementen: een reis over de tafel is een reis door chemie. [PDF]. Hersteld van: kabeljauw.Edu
- « Veroudering waargenomen factoren, gevolgen en voorbeelden
- Objectieve kunstgeschiedenis, kenmerken, vertegenwoordigers en werken »

