Prolineigenschappen, structuur, functies, voedsel
- 3059
- 165
- Hugo Crooks
De Proline (Pro, P) behoort tot de 22 aminozuren die zijn geclassificeerd als basis. Het is een niet -essentieel aminozuur, omdat het kan worden gesynthetiseerd door mens en andere zoogdieren.
In 1900 was de Duitse wetenschapper Richard Willstatter de eerste die de proline uithaalde en observeerde. Het was echter Emili Fischer, in 1901, die de term "proline" bedacht op basis van de pyrrolidinering van het aminozuur; Deze onderzoeker slaagde er ook in om de synthese van de proline uit de melkcaseïne in detail uit te leggen.
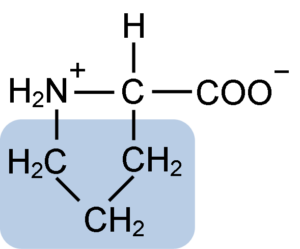 Chemische structuur van proline-aminozuur (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Chemische structuur van proline-aminozuur (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) In eiwitten zoals caseïne heeft proline een onmisbare functie in "beurten" en structureel vouwen. In dit eiwit wordt de proline homogeen verdeeld over de structuur en links naar het β -caseïne en het αS1 -eiwit; Bovendien voorkomt het defecte structurele lussen of vouwen.
In de biochemische analyses die momenteel worden gebruikt om de exacte volgorde van aminozuren te bepalen die de eiwitten vormen, is de proline een van de moeilijkste detectie -aminozuren, omdat de secundaire aminogroep van de proline een ander gedrag heeft en niet gemakkelijk kan worden gedetecteerd en niet gemakkelijk kan worden gedetecteerd en kan niet gemakkelijk worden gedetecteerd.
Scurvy is misschien wel de bekendste ziekte gerelateerd aan proline. Het heeft te maken met een tekort aan vitamine C -inname, die direct de hydroxylering van de proline in de collageenvezels beïnvloedt, wat systemische verzwakking veroorzaakt vanwege de instabiliteit van de collageenvezels die overal in het lichaam zijn.
[TOC]
Kenmerken
De koolstofgebonden secundaire aminogroep α maakt de proline -classificatietaak enigszins moeilijk. In sommige teksten wordt dit echter geclassificeerd naast de vertakte aminozuren of met alifatische zijketens, omdat de zijketen of R R van de proline hydrofoob of alifatisch is.
Een van de belangrijkste kenmerken van de proline is dat in geen geval waterstofbruggen kunnen vormen, waardoor het ideaal is om complexe en ingewikkelde bochten in de tertiaire structuren van eiwitten te structureren.
Net zoals alle aminozuren twee isovormen hebben die afhankelijk zijn van het centrale koolstofatoom, kan de proline in de natuur worden gevonden, zoals L-proline of als D-prolol. Form L-prolina is echter het meest voorkomende aard en is degene die deel uitmaakt van de eiwitstructuren.
In de eiwitten waar het zich bevindt, beslaat de proline vaak plaatsen dicht bij het oppervlak of de vouw of "draaien" van de polypeptideketen, omdat de rigide en gesloten structuur van de proline een sterke interactie maakt met andere aminozuurinteractie moeilijk.
Structuur
De proline heeft een bepaalde structuur tussen basisaminozuren, omdat het een aminogroep (NH2) secundair presenteert en niet de primaire aminogroep die kenmerkend is voor alle aminozuren.
Groep R of de laterale keten van de proline is een pyrrolidine- of tetrahydropirrolring. Deze groep wordt gevormd door een heterocyclisch amine (geen dubbele bindingen) van vijf koolstofatomen, waarbij elk van deze verzadigd is met waterstofatomen.
De proline heeft de eigenaardigheid dat het "centrale" koolstofatoom is opgenomen in de heterocyclische pyrolidinring, dus de enige "vrije" of "uitstekende" atomen zijn de carboxylgroep (COOH) en de waterstofatoom (h) van de heterocyclische ring van het aminozuur.
Kan u dienen: Superoxide dysmutase: kenmerken, structuur, functiesDe moleculaire formule van de proline is C5H9NO2 en de IUPAC-naam is pirrolidine-2-carbonzuur. Het heeft een geschat molecuulgewicht van 115,13 g/mol en de frequentie van uiterlijk in eiwitten is ongeveer 7%.
Functie
Collageen- en tropocollageenvezels zijn de meest voorkomende eiwitten in de meeste gewervelde dieren. Deze vormen de huid, pezen, botmatrix en vele andere weefsels.
Collageenvezels bestaan uit veel drievoudige polypeptide-triggers die op hun beurt zijn samengesteld uit meerdere proline- en glycineresten in de glycine-patoline-proline/hydroxiprololine-sequentie (de laatste is een gemodificeerde afgeleide van de proline).
In zijn natieve vorm maakt de proline deel uit van de procollagen, dit is een voorloper van de polypeptiden van het collageen en enkele andere eiwitten van het bindweefsel. Het enzymproline hydroxylase.
Wat is de belangrijkste functie van de proline in de collageenvezels?
Hydroxyproline geeft collageenweerstandskenmerken, omdat dit aminozuurderivaat het vermogen heeft om een groot aantal waterstofbruggen te vormen tussen de drievoudige propellerketens die het eiwit vormen.
De enzymen die de hydroxylering van prolineafval katalyseren, vereisen de aanwezigheid van vitamine C (ascorbinezuur) en, zoals hierboven vermeld, is de scheurbuik te wijten aan het verzwakken van collageenvezels als gevolg van fouten in de hydroxylering van prolineafval, wat een afname van een afname waterstofbruggen die collageenvezels ondersteunen.
Andere functies
Proline is onmisbaar voor de vorming van vouwen en eiwitbeurten.
De gesloten structuur maakt dit aminozuur moeilijk om in eiwitten te "accommoderen", omdat het geen waterstofbruggen kan vormen om te "interageren" met ander nabijgelegen afval, induceert het de vorming van "beurten" of "draait" langs de structuur van eiwitten waar is het.
Alle eiwitten met een korte levenstijd hebben ten minste een regio met overvloedige herhaalde proline, glutamaat, serine en tronine. Deze regio's gaan van 12 naar 60 afval en worden ongedierte -sequenties genoemd.
Eiwitten die de plaagsequentie bevatten, worden gemarkeerd door ubiquitinatie voor daaropvolgende afbraak in proteosomen.
Biosynthese
Veel aminozuren kunnen worden gesynthetiseerd uit glycolyse -intermediairs, van het pentosefosfaat of de citroenzuurcyclus (Krebs -cyclus). Proline en arginine worden gevormd op de korte glutamaatroutes.
De vrijwel gemeenschappelijke biosynthetische route voor alle levende organismen begint met de omzetting van L-glutamaat in γ-L-L-Glutamil-5-fosfaat dankzij de werking van het glutamaat-5-quo-enzym (in bacteriën) of door de γ-glutamil- Whinas (bij mensen).
Deze reactie impliceert ATP -afhankelijke fosforylering, dus naast het hoofdproduct wordt een ADP -molecuul gegenereerd.
De reactie gekatalyseerd door glutamaat 5-semi-limide dehydrogenase (in bacteriën) of door het γ-glutamil-reductase-fosfaat (bij mensen) brengt het γ-l-l-l-glutamil-5-fosfaat om in L-glutamaat-5-semi-limide aanwezigheid van Co -factor NADPH.
Kan u van dienst zijn: Half Stuart: fundering, voorbereiding en gebruikDe L-glutamato-5-semialdehyde is omkeerbaar en spontaan gedehydrateerd tot (s) -1-1-pyrool), in wiens reactie een molecuul van NADPH of NADH is ook noodzakelijk.
Degradatie
Proline, arginine, glutamine en histidine worden constant afgebroken tot a-zetoglutaraat om de cyclus van citroenzuur of Krebs-cyclus in te voeren. In het specifieke geval van de proline wordt dit eerst geoxideerd door het proline-oxidase-enzym tot pirroline-5-carboxylaat.
In de eerste stap, waarbij de oxidatie van het proline tot pirroline-5-carboxylaat optreedt, worden de losgemaakte protonen geaccepteerd door de E-FAD, terug naar e-FADH2; Deze stap is exclusief voor proline -aminozuur.
Vanwege een spontane reactie wordt pirroline-5-carboxylaat getransformeerd in γ-semialdehyde glutamaat, dat vervolgens dient als een substraat voor het enzym glutamaat γ-semi-limidische dehydrogenase. In deze stap twee protonen ontstaan, een van hen wordt geaccepteerd door de NAD die wordt gereduceerd tot NADH, en de andere is vrij in de vorm van H+.
Arginine wordt, net als de proline, getransformeerd in γ-semialdehyde glutamaat, maar door een alternatieve metabole route waaraan twee verschillende enzymen deelnemen.
Het γ-semialdehyde glutamaat-enzym dehydrogenase transformeert glutamaat γ-semialdehyde in L-glutamaat. Vervolgens wordt dit L-glutamaat opnieuw geoxideerd door een enzym glutamaatdehydrogenase, dat uiteindelijk het a-zetoglutaraat vormt dat in de citroenzuurcyclus zal worden opgenomen.
In de oxidatiebehandeling van glutamaat wordt een proton (H+) vrijgegeven en een aminogroep (NH3+). Het proton vermindert een NADP+ -groep en een NADPH -molecuul komt uit.
Ondanks de vele overeenkomsten die bestaan tussen de afbraak- en biosyntheseroutes van de proline en de arginine, worden deze aminozuren gesynthetiseerd en afgebroken door volledig tegengestelde routes die verschillende enzymen, verschillende cofactoren gebruiken en verschillende intracellulaire compartimenten.
Voedsel rijk aan Valina
Over het algemeen hebben alle voedingsmiddelen met een hoog eiwitgehalte grote hoeveelheden proline. Onder deze zijn vlees, melk, eieren en anderen. Wanneer ons lichaam zich echter in een optimale staat van gezondheid en voeding bevindt, kan het proline -endogeen synthetiseren.
De proline is ook te vinden in veel peulvruchten en noten en in volle granen zoals havermout, bijvoorbeeld. Andere proline -voedingsmiddelen zijn onder andere tarwezemelen, noten, amandelen, erwten, bonen, bonen.
Sommige naturistenwinkels formuleren meestal gecomprimeerd uit de aminozuren L-Lisina en L-prololina gecombineerd om mensen met gewrichtsproblemen te helpen of om het verouderen van weefsels uit te stellen.
Het is echter niet zeker aangetoond dat het innemen van voedingssupplementen van deze aminozuren een significant effect heeft op de vertraging van de ouderdom of andere omstandigheden van de leeftijd van de leeftijd.
Voordelen van uw inname
Diëten die rijk zijn aan proline worden meestal voorgeschreven voor mensen met gewrichtsziekten zoals artritis, verstuikingen, ligamentbreuk, dislocaties, peesonitis en anderen, en dit is te wijten aan hun relatie met de synthese van collageenvezels die aanwezig zijn in bodybindingsweefsels.
Kan u van dienst zijn: agar m.R.S: Wat is, fundering, voorbereiding, gebruikVeel van de farmacologische lotions en tabletten die in de esthetische industrie worden gebruikt, zijn verrijkt met L-proline, omdat sommige onderzoeken hebben aangetoond dat dit aminozuur de collageensynthese op de een of andere manier kan verhogen en daarom de textuur van de huid kan verbeteren, de genezing van wonden versnellen, scheuringen, zweren en brandwonden.
In de voedingsindustrie zijn er eiwitten met "bioactieve peptiden" die oefening functioneert buiten hun voedingsseigenschappen. Deze peptiden hebben over het algemeen twee tot negen aminozuurafval waaronder proline, arginine en lysine in overvloed aanwezig.
Deze bioactieve peptiden kunnen antihypertensieve activiteit hebben met een bepaald opioïde -effect; Ze kunnen als immunomodulatoren fungeren door de immuunrespons tegen sommige ziekteverwekkers te stimuleren en kunnen zelfs toename van vasoactiviteit veroorzaken, wat de circulatie verbetert van degenen die ze consumeren.
Deficiëntiestoornissen
Gluten is een eiwit aanwezig in de korrels van tarwe die darmontsteking veroorzaakt. Mensen die lijden aan "glutenintolerantie" staan bekend als "coeliakie" patiënten en het is bekend dat dit eiwit rijk is aan proline en glutamine, waarvan de proteolytische afbraak moeilijk is voor mensen met een dergelijke toestand.
Sommige ziekten hebben te maken met het slechte vouwen van belangrijke eiwitten en het is heel gebruikelijk dat deze defecten te maken hebben met isomerisatie Cis-trans van Amida -links in proline -afval, omdat, in tegenstelling tot andere peptidekoppelingen waarin de isomeer trans Het is zeer de voorkeur, in de proline is het benadeeld.
In proline -afval is waargenomen dat er een significante neiging is tot de vorming van de isomeer Cis Eerst dan de isomeer trans In de aangrenzende amiden voor prolineafval, die een "onjuiste" conformatie van eiwitten kan genereren.
Stofwisselingsziekten
Net als bij andere essentiële en niet -essentiële aminozuren, moeten de belangrijkste pathologische aandoeningen die verband houden met de proline, meestal, met defecten op de assimilatieroutes van dit aminozuur.
Hyperprolinemie is bijvoorbeeld een typisch geval van tekortkoming in een van de enzymen die deelnemen aan de proline-afbraakroute, specifiek in de 1-pyroline-5-carboxylaatdehydrogenase, die leidt tot een accumulatie van het substraat, die uiteindelijk inactief de route.
Deze pathologie wordt meestal gediagnosticeerd door hoge proline-inhoud in bloedplasma en door de aanwezigheid van de 1-pyrrolololine-5-carboxylaatmetaboliet in de urine van getroffen patiënten.
De belangrijkste symptomen van deze ziekte bestaan uit neurologische aandoeningen, nierziekten en verlies van auditieve capaciteit of doofheid. Andere meer ernstige gevallen zijn ernstige mentale vertraging en duidelijke psychomotorische problemen.
Referenties
- Abu-Baker, s. (2015). Review van biochemie: concepten en verbindingen
- Delauney, een. J., & Verma, D. P. S. (1993). Proline -biosynthese en osmoregulatie in planten. The Plant Journal, 4 (2), 215-223.
- Lijst, b., Lerner, r. NAAR., & Barbas, c. F. (2000). Proline-gekatalyseerde directe asymmetrische aldolreacties. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Plimmer, r. H. NAAR. (1912). De chemische constitutie van de eiwitten (vol. 1). Longmans, groen.
- Szabados, L., & Savouré,. (2010). Proline: een multifunctioneel aminozuur. Trends in Plant Science, 15 (2), 89-97.

