Typtofaan -kenmerken, structuur, functies, voordelen
- 1667
- 104
- Pete Heaney V
Hij Tryptofaan (TRP, W) is een aminozuur geclassificeerd in de groep essentiële aminozuren, omdat het menselijk organisme het niet kan synthetiseren en het via het dieet moet verkrijgen.
Sommige voedingsmiddelen zoals melk en hun derivaten, vlees, eieren en sommige granen zoals quinoa en soja bevatten essentiële aminozuren en zijn daarom een belangrijke bron van tryptofaan.
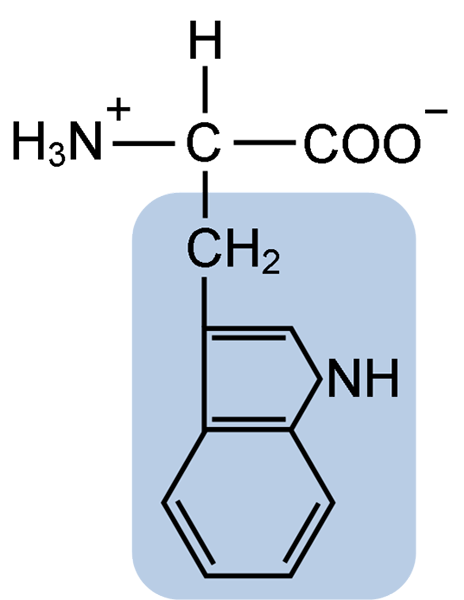
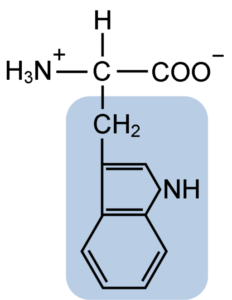 Chemische structuur van het typtofaan aminozuur (bron: clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Chemische structuur van het typtofaan aminozuur (bron: clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) In de natuur zijn meer dan 300 verschillende aminozuren bekend en vormen slechts 22 de monomere eenheden van celeiwitten. Onder de laatste zijn 9 essentiële aminozuren, waaronder tryptofaan, maar de essentie van elk verschilt tussen de ene soort en de andere.
De tryptofaan heeft verschillende functies, waaronder hun deelname aan eiwitsynthese, in de synthese van serotonine, een krachtige vasoconstrictor en neurotransmitter, van melatonine en in de synthese van de co -founder NAD.
In het plantenrijk is tryptofaan een fundamentele voorloper van het plantenhormoon dat bekend staat als auxine (indol-3-azijnzuur). Het kan worden gesynthetiseerd door sommige bacteriën zoals EN. coli Van de Corismato, die wordt geproduceerd uit sommige glycolytische derivaten zoals fosfoenolpiruvaat en erythrosa-4-fosfaat.
De afbraak ervan bij zoogdieren komt voor in de lever, waar het wordt gebruikt voor de synthese van acetylco-enzym A (acetyl-CoA), en om deze reden wordt het beschreven als een aminozuur dat glucogeen roept, omdat het de glucosevormingscyclus kan betreden.
Verschillende studies zijn gemeld met controversiële resultaten met betrekking tot het gebruik van tryptofaan als voedingssupplement voor de behandeling van sommige pathologieën zoals depressie en sommige slaapstoornissen onder andere.
Er zijn enkele ziekten gerelateerd aan aangeboren defecten in het aminozuurmetabolisme. In het geval van Typtophan kan de ziekte van Hartnup worden aangesteld als gevolg van tryptofaan -2,3 -monoxigenase, een recessieve erfelijke ziekte die wordt gekenmerkt door mentale retardatie en veranderingen van het pelagra type van het huidtype.
[TOC]
Kenmerken
Samen met fenylalanine en tyrosine wordt tryptofaan gevonden in de groep aromatische en hydrofobe aminozuren.
Tryptofaan wordt echter gekenmerkt door een enigszins hydrofoob aminozuur te zijn, omdat de aromatische zijketen, door polaire groepen te hebben, die hydrofobiciteit verzwakt.
Voor het hebben van gecombineerde ringen hebben ze een sterke absorptie van licht in het spectrumgebied dicht bij ultraviolet en dit kenmerk wordt vaak gebruikt voor de structurele analyse van eiwitten.
Het absorbeert ultraviolet licht (tussen 250 en 290 nm) en hoewel dit aminozuur niet erg overvloedig is in de structuur van de meeste eiwitten van de mens 280 nm van de meeste eiwitten.
Tryptophan dagelijkse vereisten verschillen met de leeftijd. Bij zuigelingen tussen 4 en 6 maanden is de gemiddelde vereiste ongeveer 17 mg per kilogram gewicht per dag; Bij kinderen van 10 tot 12 jaar is het 3,3 mg per kilogram gewicht per dag en bij volwassenen is het 3,5 mg per kilogram gewicht per dag.
Tryptofaan wordt geabsorbeerd door darmroute en is tegelijkertijd een ketogeen en glycogeen aminozuur.
Omdat het een serotonine -voorloper is, een belangrijke neurotransmitter, moet de tryptofaan het centrale zenuwstelsel (CNS) bereiken en daarvoor moet het de bloedhersenbarrière overschrijden, waarvoor er een specifiek actief transportmechanisme is.
Kan u van dienst zijn: Biggy Agar: foundation, voorbereiding en gebruikStructuur
Tryptofaan heeft een moleculaire formule C11H12N2O2 en dit essentiële aminozuur heeft een aromatische zijketen.
Zoals alle aminozuren heeft tryptofaan een a -koolstofatoom bevestigd aan een aminogroep (NH2), een waterstofatoom (H), een carboxylgroep (COOH) en een zijketen (R) gevormd door een heterocyclische structuur, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep, de indolgroep.
De chemische naam is 2-amino-3-propionzuur, het heeft een moleculaire massa van 204,23 g/mol. De oplosbaarheid bij 20 ° C is 1,06 g in 100 g water en heeft een dichtheid van 1,34 g/cm3.
Functie
In de mens wordt de tryptofaan gebruikt voor eiwitsynthese en is het onmisbaar voor serotoninevorming (5-hydroxitriptamine) een krachtige vasoconstrictor, die de gladde spiercontractie stimuleert (vooral in de dunne darm) en een neurotransmitter die kan worden gemaakt, combinatie van psychische stimulatie, gevechtsdepressie, gevechtsdepressie, gevechtsdepressie, gevechtsdepressie, gevechtsdepressie, combinatie en reguleer angst.
Tryptofaan is een voorloper in de synthese van melatonine en heeft daarom implicaties in slaap- en wake -cycli.
Dit aminozuur wordt op een van de drie manieren als voorloper gebruikt voor de vorming van de NAD-cofactor, een zeer belangrijke cofactor die deelneemt aan een verscheidenheid aan enzymatische reacties gerelateerd aan gebeurtenissen met oxide-reductie.
Tryptofaan en sommige van zijn voorlopers worden gebruikt voor de vorming van een vegetatiehormoon genaamd auxine (indol-3-actief zuur). Auxines zijn plantenhormonen die groei, ontwikkeling en vele andere fysiologische functies van planten reguleren.
Biosynthese
In de organismen die het kunnen synthetiseren, is het koolstofskelet van de tryptofaan afgeleid van het fosfoenolpyruvaat en erythrosa-4-fosfaat. Deze worden op hun beurt gevormd uit een intermediair van de Krebs -cyclus: oxalacetaat.
Fosfoenolpiruvaat en erythrous-4-fosfaat worden gebruikt voor corismate synthese op een zeven enzymatische route. Fosfoenolpiruvaat (PEP) is een product van glycolyse en erythrous-4-fosfaat van de pentose-fosfaatroute.
Hoe is de Corismate Synthesis -route?
De eerste stap van de symptomen van Corismato is de vereniging van de PEP met het erythrosa-4-fosfaat om 2-zo-3-disoxxi-d-anabino-heptulosonato-7-fosfaat (DAHP) (DAHP) te vormen (DAHP).
Deze reactie wordt gekatalyseerd door het enzym 2-zo-3-dexxi-d-anabino-heptulosonato-7-fosfaatsynthase (DAHP Syntasa), dat wordt geremd door het Corismate.
De tweede reactie impliceert de ciclatie van de DAHP door het synthase -dehydrochinaat, een enzym dat de co -factor NAD vereist, die tijdens deze reactie wordt verminderd; Als gevolg hiervan treedt 5-dishydroquinaat op.
De derde stap van deze route impliceert de eliminatie van een watermolecuul van 5-dehydroquinaat, reactie gekatalyseerd door het enzym dehydratase dehydrochinaat, waarvan het eindproduct overeenkomt met de 5-dishydro shikimato.
De keto -groep van dit molecuul is gereduceerd tot een hydroxylgroep en als gevolg daarvan wordt Shikimato gevormd. Het enzym dat deze reactie katalyseert, is de NADPH-afhankelijke afhankelijke afhankelijke afhankelijke.
De vijfde stap van de route impliceert de vorming van 5-fosfaat Shikimate en de consumptie van een ATP-molecuul door een enzym dat bekend staat als kinase shikimato, belast met de fosforylering van Shikimate in positie 5.
Vervolgens wordt vanuit 5-fosfaat Shikimate en door de werking van de 3-Enlappiruvil Shikimato-5-fosfaatsynthase, 3-Enlappiruvil Shikimato 5-fosfaat gegenereerd. Het bovengenoemde enzym bevordert de verplaatsing van de fosforylgroep van een tweede PEP-molecuul door de hydroxylgroep van koolstof in positie 5 van 5-fosfaat Shikimate.
Het kan u van dienst zijn: waarom is het belangrijk om voor de biodiversiteit te zorgen?De zevende en laatste reactie wordt gekatalyseerd door het synthase-corism, dat fosfaat elimineert uit het 3-rendement Shikimate 5-fosfaat en het corismaat maakt.
In de schimmel N. Crassa, Een enkel multifunctioneel enzymatisch complex katalyseert vijf van de zeven reacties van deze route en dit complex wordt drie andere enzymen toegevoegd die uiteindelijk tryptofaan genereren.
Tryptofaansynthese in bacteriën
In EN. coli, Transformatie van tryptofaan Corism omvat een vijf extra enzymatische route:
Ten eerste zet het antranilaatsynthase -enzym de corismate om in antranilaat. In deze reactie neemt een glutaminemolecuul deel, geschonken door de aminogroep die bindt aan de indolring van de tryptofaan en wordt glutamaat.
De tweede stap wordt gekatalyseerd door het fosforibosyltransferase antranilaat. In deze reactie wordt een pyrofosfaatmolecuul van het 5-fosforibosyl-1-pyrofosfaat (PRPP) (PRPP) rijk aan energie en de n- (5'-fosforibosyl) gevormd, wordt gevormd.
De derde reactie van deze tryptofaan-syntheseroute impliceert de deelname van het fosforibosyl-isomerase-enzym. Hier de n- (5'-phorribosyl) -santhranylaat.
Later wordt het indool-3-glycerolfosfaat gevormd, in een reactie gekatalyseerd door de indol-3-glycerol sympathy synthase, waarbij een CO2 en een H2O-molecuul worden vrijgegeven en de 1- (o-carboxyfenylamine) -1-desoxyribulosa 5-fosfaat worden.
De laatste reactie van deze route vormt uiteindelijk tryptofaan wanneer de tryptofaan synthase katalyz.
Degradatie
Bij zoogdieren wordt tryptofaan in de lever afgebroken tot acetyl-CoA op een route die twaalf enzymatische stappen omvat: acht om a-zo-stoadipaat te bereiken en er nog 4 om de a-zo-dotadipato om te zetten in acetylco-enzyme.
De volgorde van afbraak tot α-cetoadipato is:
Typtophan → N-Quinurenine Formil → Quinurenin → 3-hydroxi quinurenine → 3-hydroxy-antranilaat → ε-semialdehyde 2-amino-3-muconcycix veel → ε-semialdehido α-amino muconic amouz.
De enzymen die deze reacties respectievelijk katalyseren, zijn:
Typtophan 2-3-dioxigenase, formamidase quinurenine, NADPH-afhankelijke monooxigenase NADPH-afhankelijk.
Zodra a-cethoadipaat is gegenereerd, wordt oxidatieve decarboxylering gevormd gluteral-CoA. Dit, door ß-oxidatie, glutaconyl-CoA-vorm die een bicarbonaat-koolstofatoom (HCO3-) verliest, wint een watermolecuul en eindigt als Crotonil-CoA.
Crotonil-CoA, ook voor ß-oxidatie, levert acetyl-CoA op. Zei Acetyl-CoA kan op verschillende manieren volgen, waaronder gluconeogenese, om glucose en de Krebs-cyclus te vormen, om ATP te vormen, indien nodig, indien nodig, indien nodig, indien nodig.
Dit molecuul kan echter ook worden gericht op de vorming van ketonlichamen, die uiteindelijk als energiebron kunnen worden gebruikt.
Voedsel rijk aan tryptofaan
Rood vlees in het algemeen, kip en vis (vooral blauwe vissen zoals zalm en tonijn) zijn vooral rijk aan tryptofaan. Melk en zijn derivaten, eieren, vooral de dooier, zijn ook voedingsmiddelen met veel tryptofaangehalte.
Andere voedingsmiddelen die dienen als een natuurlijke bron van dit aminozuur zijn:
- Onder andere noten zoals noten, amandelen, pistachenoten en anacardos.
- Rijstgranen.
- Droge granen zoals bonen, linzen, kikkererwten, sojabonen, quinoa, enz.
- Biergist en verse bonen, bananen en bananen, ananas of ananá, avocado, pruimen, waterkers, broccoli, spinazie en chocolade.
Het kan u van dienst zijn: onderzeeërhaai: geschiedenis, realiteit of fictie?Voordelen van uw inname
Typtophan -consumptie is absoluut noodzakelijk om al die eiwitten die het in zijn structuur en door zijn verschillende functies opnemen te synthetiseren.
Naast de bekende effecten op de stemming komt serotonine (getryptofaan afgeleid) tussenbeide in meerdere cognitieve functies die verband houden met leren en geheugen die daarom ook gerelateerd zijn aan tryptofaan.
Er zijn gegevens die de relatie aantonen tussen stemming, serotonine en gastro-intestinale-cerebrale as als een systeem van bidirectionele invloeden tussen emotionele en cognitieve centra van de hersenen en de perifere functie van de spijsverteringskanaal.
Gebruik als voedingssupplement voor de behandeling van sommige aandoeningen, met name die gerelateerd aan het centrale zenuwstelsel, is zeer controversieel omdat het concurrerende transport met neutrale aminozuren, veel overvloediger, het moeilijk maakt om een significante en aanhoudende toename in tryptofaan te bereiken. haar mondelinge administratie.
Ondanks deze controverses is het gebruik ervan gepostuleerd als een aanvulling in:
- Pijnbehandeling
- Slaapproblemen
- Depressiebehandeling
- Manie behandeling
- Eetlustreductie
Deficiëntiestoornissen
De centrale eliminatie of gebrek aan tryptofaan gaat gepaard met depressie, mislukkingen in aandacht, afname van geheugen, slaap en angststoornissen.
Bij depressieve patiënten en met suïcidale trends zijn veranderingen in de concentratie van bloed en cerebrospinale vloeistof gevonden. Bovendien vertonen sommige patiënten met nerveuze anorexia lage serumspiegels van tryptofaan.
Sommige polyurische patiënten, die vitamine B6 en zink verliezen, hebben vaak fobieën en angst en verbeteren met voedingssupplementen die rijk zijn aan triptofaan.
Carcinoïde syndroom wordt gekenmerkt door de aanwezigheid van dunne darmtumoren die diarree, vasculaire ziekten en bronchoconstrictie veroorzaken en is gerelateerd aan het niacine- en tripofaantekort
Pelagra is een pathologische aandoening die gepaard gaat met diarree, dementie, dermatitis en kan de dood veroorzaken, dit wordt ook behandeld met niacine- en tryptofaansupplementen.
De ziekte van Hartnup moet onder sommige dingen doen, met een defect in het metabolisme van verschillende aminozuren, waaronder tryptofaan.
In het geval door een tekort van het typtofaan -2,3-monoxigenase-enzym, is dit een recessieve erfelijke ziekte die wordt gekenmerkt door mentale retardatie en huidveranderingen van het huidtype.
Referenties
- Halvorsen, K., & Halvorsen, s. (1963). Hartnup -ziekte. Kindergeneeskunde, 31(1), 29-38.
- Hood, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Don's paniek. Een gids voor tryptofaan-uitputting met stoornisspecifieke angstprovocatie. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, T. NAAR., Nguyen, j. C., Polglaze, k. EN., & Bertrand, p. P. (2016). Invloed van tryptofaan en serotonine op stemming en cognitie met een mogelijke rol van de darmboin-as. Voedingsstoffen, 8(1), 56.
- Kaye, W. H., Barbarich, n. C., Putnam, k., Gendall, K. NAAR., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Anxiolytische effecten van acute tryptofaan -uitputting in anorexia nervosa. International Journal of Eating Disorders, 33(3), 257-267.
- Murray, r. K., Granner, D. K., Mayes, p., & Rodwell, V. (2009). Harper's geïllustreerde biochemie. 28 (P. 588). New York: McGraw-Hill.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- « Prolineigenschappen, structuur, functies, voedsel
- Catalaps veroorzaakt, symptomen en behandeling »

