Isobarische procesformules, vergelijkingen, experimenten, oefeningen

- 2733
- 430
- Pete Heaney V
In een Isobarisch proces, de druk P van een systeem blijft constant. Het voorvoegsel "ISO" komt uit het Grieks en wordt gebruikt om aan te geven dat er iets constant blijft, terwijl "Baros", ook uit het Grieks, gewicht betekent.
De isobarische processen zijn zeer eigen, zowel in gesloten containers als in open ruimtes, omdat ze eenvoudig zijn om ze in de natuur te vinden. Hiermee bedoelen we dat fysische en chemische veranderingen mogelijk zijn op het aardse oppervlak of chemische reacties in open containers op de atmosfeer.
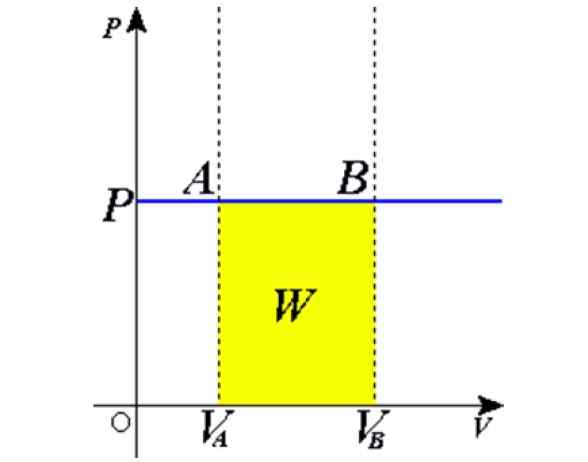 Figuur 1. Isobarisch proces: de blauwe horizontale lijn is een isobara, wat constante druk betekent. Bron: Wikimedia Commons.
Figuur 1. Isobarisch proces: de blauwe horizontale lijn is een isobara, wat constante druk betekent. Bron: Wikimedia Commons. Sommige voorbeelden worden verkregen door een ballon vol lucht, koken, koken of ijskoud water, de stoom die wordt gegenereerd in de ketels of het proces van het grootbrengen van een ballon in de ketels, de stoom die wordt gegenereerd, wordt verkregen,. Later zullen we een uitleg van deze gevallen geven.
[TOC]
Formule en vergelijkingen
We leiden een vergelijking af voor het isobarische proces, ervan uitgaande dat het onderzochte systeem een ideaal gas is, een vrij geschikt model voor bijna elk gas bij minder dan 3 drukatmosferen. De ideale gasdeeltjes bewegen willekeurig, bezetten het gehele volume van de ruimte die ze bevat zonder met elkaar te communiceren.
Als het ideale gas dat is vergrendeld in een cilinder die met een beweegbare zuiger wordt verstrekt, langzaam kan uitbreiden, kan worden aangenomen dat zijn deeltjes te allen tijde in evenwicht zijn. Dan oefent het gas op het gebied zuiger NAAR een kracht F Grootte:
F = P.NAAR
Waar P Het is gasdruk. Deze kracht oefent een taak uit die een oneindige verplaatsing produceert Dx In de zuiger gegeven door:
dw = fdx = pa.Dx
Zoals het product ADX Het is een volumeverschillen Dv, Dus DW = PDV. Het blijft om beide kanten te integreren van het oorspronkelijke volume VNAAR Tot het laatste deel VB Om het totale werk van het gas te verkrijgen:


[TOC]
Experimenten
De beschreven situatie wordt experimenteel geverifieerd met een gas in een cilinder voorzien van een beweegbare zuiger, zoals getoond in figuren 2 en 3. Een zuiger wordt op de zuiger geplaatst, wiens gewicht wordt gericht, terwijl het gas een kracht uitoefent dankzij de P -druk die op de zuiger produceert.
Het kan u van dienst zijn: Imantation: wat bestaat, methode en voorbeelden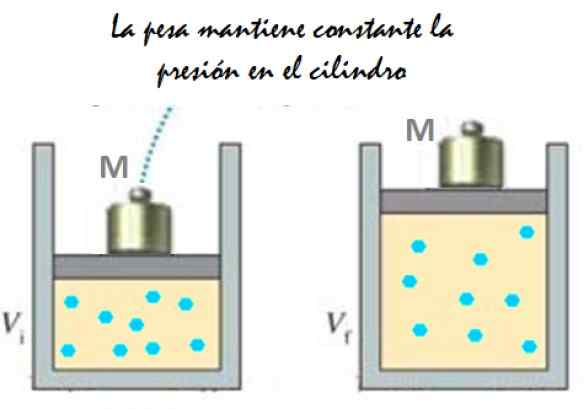 Figuur 2. Experiment dat bestaat uit het uitbreiden van een constant drukgas. Bron: f. Zapata.
Figuur 2. Experiment dat bestaat uit het uitbreiden van een constant drukgas. Bron: f. Zapata. Omdat de zuiger vrij kan bewegen, kan het volume dat gas bezet zonder probleem veranderen, maar de druk blijft constant. Atmosferische druk toevoegen PGeldautomaat, dat ook een kracht uitoefent, je hebt:
Mg - P.A + PGeldautomaat . A = constant
Daarom: p = (mg/a) + pGeldautomaat Het varieert niet, tenzij m en daarmee het gewicht is gewijzigd. Door warmte aan de cilinder toe te voegen, zal het gas het volume vergroten of het samentrekt bij het extraheren van warmte.
Isobarische processen in het ideale gas
De ideale gasstatusvergelijking relateert belangvariabelen: druk p, volume v en temperatuur t:
P.V = n .R.T
Hier vertegenwoordigt n het aantal mol en R is de constante van de ideale gassen (geldig voor alle gassen), die wordt berekend door de Boltzmann -constante te vermenigvuldigen met het Avogadro -nummer, wat resulteert in:
R = 8.31 J/Mol K
Wanneer de druk constant is, kan de toestandsvergelijking worden geschreven als:
V/t = nr/p
Maar nr/p is constant, omdat n, r en p zijn. Dus wanneer het systeem van de ene staat 1 naar de andere staat 2 overgaat, ontstaat het volgende aandeel, ook bekend als de wet van Charles:
V1/T1 = V2/T2
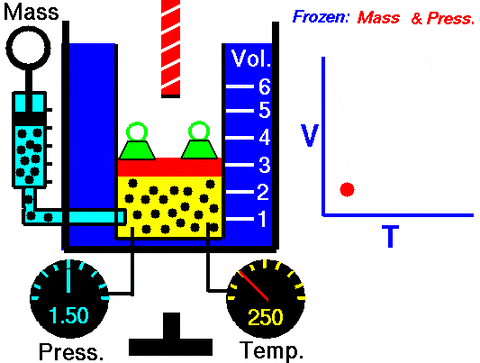 figuur 3. Animatie die de uitbreiding van constant drukgas toont. Rechts de grafiek van het volume afhankelijk van de temperatuur, wat een lijn is. Bron: Wikimedia Commons. NASA's Glenn Research Center [Public Domain].
figuur 3. Animatie die de uitbreiding van constant drukgas toont. Rechts de grafiek van het volume afhankelijk van de temperatuur, wat een lijn is. Bron: Wikimedia Commons. NASA's Glenn Research Center [Public Domain]. Vervangen W = pδv, Het werk dat wordt gedaan om van toestand 1 naar 2 te gaan, in termen van de constanten en de temperatuurvariatie, gemakkelijk te meten met een thermometer:
W1 → 2 = nr (t2 - T1) = NR.AT
Aan de andere kant bepaalt de eerste wet van de thermodynamica dat:
∆U = q - w
Dit betekent dat het toevoegen van het gas een bepaalde hoeveelheid warmte Q, de interne energie ∆U toeneemt en de trillingen van zijn moleculen toenemen. Op deze manier breidt gas uit en voert het werk uit door de zuiger te verplaatsen, zoals we eerder hebben gezegd.
In een ideaal monoatomisch gas en de variatie van interne energie ∆U, die zowel kinetische energie als de potentiële energie van zijn moleculen omvat, is:
∆U = (3/2)Nr Δt
Eindelijk combineren we in één de uitdrukkingen die we hebben verkregen:
Q = ∆U + w = (3/2)Nr Δt + NR∆t = (5/2) Nr Δt
Als alternatief kan dat worden herschreven in termen van massa M, het temperatuurverschil en een nieuwe constante genaamd Specifieke warmtewarmte Bij constante druk, afgekort CP, wiens eenheden J/Mol K zijn:
Kan je dienen: Venus (planeet)Q = M CP ∆T
Voorbeelden
Niet alle isobarische processen worden uitgevoerd in gesloten containers. In feite treden ontelbare thermodynamische processen van alle soorten atmosferische druk op, dus de isobarische processen komen zeer vaak van aard. Dit omvat fysische en chemische veranderingen op het aardoppervlak, chemische reacties in open containers en nog veel meer.
Om isobare processen in gesloten systemen te laten plaatsvinden, is het noodzakelijk dat hun grenzen flexibel genoeg zijn om veranderingen in volume mogelijk te maken zonder de druk van de druk.
Dit was wat er gebeurde in het zuigerexperiment dat gemakkelijk bewoog toen het gas zich uitbreidde. Hetzelfde gebeurt door een gas in een feest te sluiten voor feesten of een hete luchtballon.
Hier hebben we verschillende voorbeelden van isobarische processen:
Kook water en kook
Koken water voor thee- of kooksauzen in open containers zijn goede voorbeelden van isobarische processen, omdat iedereen zich ontwikkelt bij atmosferische druk.
Bij het verwarmen van het water, de temperatuur en het volume nemen toe en als warmte wordt voortgezet, wordt het kookpunt eindelijk bereikt, waarbij de waterfaseverandering optreedt. Terwijl dit gebeurt, blijft de temperatuur ook constant van 100 º C.
Water bevriezen
Aan de andere kant is het vrieswater ook een isobarisch proces, of het nu in een meer plaatsvindt tijdens de winter of de binnenlandse koelkast.
Verwarm een ballon vol lucht in de zon
Een ander voorbeeld van het isobare proces is de verandering in het volume van een luchtgeblazen ballon wanneer deze aan de zon wordt blootgelegd. Het eerste ding in de ochtend, als het niet erg heet is, heeft de wereld een bepaald volume.
Naarmate de tijd verstrijkt en de temperatuur toeneemt, wordt de wereld ook verhoogd om zijn volume te verhogen en dit alles gebeurt onder constante druk. Het Globe -materiaal is een goed voorbeeld van flexibel genoeg van de grens om de lucht binnen te maken, wanneer verwarmd, breidt zich uit zonder de druk te wijzigen.
De ervaring kan ook worden uitgevoerd door de wereld aan te passen zonder inflar in de piek van een glazen fles vol met een derde van water, dat wordt verwarmd tot Maria Bio of Mary. Zodra het water wordt verwarmd, wordt de ballon onmiddellijk opgeblazen, maar er moet voor worden gezorgd om niet te veel te verwarmen, zodat het niet ontploft.
De aerostatische ballon
Het is een drijvend schip zonder voortstuwing, waardoor luchtstromen worden gebruikt om mensen en objecten te vervoeren. De bol is meestal gevuld met hete lucht, die kouder is dan de omliggende lucht, stijgt en breidt de bol ruw uit.
Kan u van dienst zijn: Triple PointHoewel luchtstromen rechtstreeks naar de bol staan, heeft het branders die worden geactiveerd om het gas te verwarmen wanneer u de hoogte wilt beklimmen of behouden, en worden gedeactiveerd bij het afdalen of landen. Dit alles gebeurt bij atmosferische druk, verondersteld constant op een bepaalde hoogte niet ver van het oppervlak.
 Figuur 4. Hete lucht ballonnen. Bron: Pixabay.
Figuur 4. Hete lucht ballonnen. Bron: Pixabay. Ketels
In de ketels wordt stoom gegenereerd door water te verwarmen en de constante druk te behouden. Dan doet deze stoom een bruikbare taak, bijvoorbeeld het genereren van elektriciteit in thermo -elektrische planten of het handelen van andere mechanismen zoals locomotieven en waterpompen.
Opgeloste oefeningen
Oefening 1
Er zijn 40 liter gas bij 27 ° C temperatuur. Zoek de volume toename bij het toevoegen van warmte isobárisch totdat deze 100 ºC bereikt.
Oplossing
De wet van Charles wordt gebruikt om het uiteindelijke volume te bepalen, maar aandacht: temperaturen moeten worden uitgedrukt in Kelvin, voeg gewoon 273 K toe aan elk:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Van:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 L/300 K) = 49.7 l
Eindelijk is de volumeverhoging V2 - V1 = 49.7 L - 40 L = 9.7 l.
Oefening 2
5 worden geleverd 5.00 x 103 J van energie tot een ideaal gas om 2 te maken.00 x 103 J van werk aan uw omgeving in een isobarisch proces. Er wordt gevraagd om te vinden:
a) De verandering in de interne gasergie.
b) De verandering in volume, als nu interne energie afneemt met 4.50 x 103 J en 7 worden uitgezet.50 x 103 J van het systeem, rekening houdend met constante druk van 1.01 x 105 vader.
Oplossing voor
Gebruikt ∆U = q - w en de waarden in de verklaring worden vervangen: Q = 5.00 x 103 J en W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Daarom neemt de interne gasergie met 3 toe met 3.00 x 103 J.
Oplossing B
Volumeverandering wordt gevonden in het gedaan werk: W = p∆v:
∆U = q - w = q - P∆v
De verklaring bevestigt dat interne energie daarom afneemt: ∆U= -4.50 x 103 J. Het vertelt ons ook dat een bepaalde hoeveelheid warmte wordt verdreven: Q = -7.50 x 103 J. In beide gevallen vertegenwoordigt het negatieve teken afname en verlies, dan:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Waar P = 1.01 x 105 vader. Aangezien alle eenheden zich in het internationale systeem bevinden, is de volumeverandering duidelijk:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 vader) = -2.97 x 10-2 M3
Aangezien volumeverandering negatief is, betekent dit dat het volume afnam, dat wil zeggen het systeem dat is gecontracteerd.
Referenties
- Byjou's. Isobarisch proces. Hersteld van: byjus.com.
- Cengel, en. 2012. Thermodynamica. 7e editie. McGraw Hill.
- XYZ -proces. Meer informatie over het isobare proces. Hersteld van: 10Process.X en Z.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9na ed. Cengage leren.
- Wikipedia. Gaswetten. Hersteld van: is.Wikipedia.borg.
- « 14 psychologische experimenten met zeer controversiële mensen
- Uitvoering concept, typen en voorbeelden »

