AUFBAU -principe

- 4498
- 881
- Cecil Graham
 Atomische orbitalen vullende volgorde volgens het AUFBAU -principe
Atomische orbitalen vullende volgorde volgens het AUFBAU -principe Wat is het AUFBAU -principe?
Hij AUFBAU -principe, Ook bekend als het regenachtige regel- of constructieprincipe, is het een praktische regel die het mogelijk maakt om de elektronische configuratie van de overgrote meerderheid van de elementen van het periodiek systeem te voorspellen, evenals die van zijn ionen.
Dit principe stelt vast dat, aangezien protonen aan de kern worden toegevoegd, één voor één om elk chemisch element achtereenvolgens te bouwen, de elektronen ook achtereenvolgens worden toegevoegd aan de minst energie -atoomorbitalen die beschikbaar zijn.
Met andere woorden, Aufbau heeft vastgesteld dat er een specifieke volgorde is volgens welke atomaire orbitalen kunnen worden gevuld. Deze bestelling wordt hieronder uitgelegd.
De volgorde van het vullen van de orbitalen volgens het principe van Aufbau
De volgorde waarin atomaire orbitalen worden gevuld hangt af van hun energieniveau. De gouden regel is dat deze energieniveaus van het minst tot de grootste worden gevuld, alsof het een gebouw is waarin de appartementen op de laagste verdiepingen moeten worden gevuld om toegang te krijgen tot de hoogste verdiepingen.
In die zin, om de volgorde van vullen van de orbitalen te voorspellen, moeten we eerst weten hoe ze worden geordend volgens hun energieniveau. In de gebouwanalogie betekent dit weten welke (orbitale) appartementen op elke verdieping zijn.
De volgende afbeelding toont de energieniveaus van de eerste atoomorbitalen die zijn besteld uit de laagste naar grotere energie.
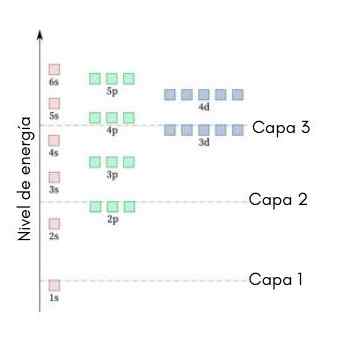
In deze afbeelding vertegenwoordigt elke foto een bepaalde orbitaal waarin slechts 2 elektronen passen. Elke groep schilderijen van dezelfde kleur vertegenwoordigt een sub -niveau van energie.
Deze sub -niveaus worden geïdentificeerd door een nummer en een letter (1S, 3p, 3D, enz.)). Het nummer geeft het belangrijkste energieniveau aan, terwijl de letter het type orbitaal aangeeft dat de groep vormt.
Het kan u van dienst zijn: aluminiumchloride (ALCL3)Volgens dit schema is het eerste sub -niveau dat moet worden gevuld de 1s (de minste energie van allemaal), dan komt de 2s, de 2p, de 3s, de 3p, de 4s, de 3d enzovoort.
De regenregel
Ondanks hoe gemakkelijk het is om de volgorde van vullen vast te stellen als je een grafiek hebt zoals de vorige, is het moeilijk om de specifieke volgorde te onthouden waarin de verschillende sub -niveaus gaan. Hiervoor wordt sommigen "de regel van regen" gebruikt.
Deze regel bestaat uit twee eenvoudige stappen:
Stap 1
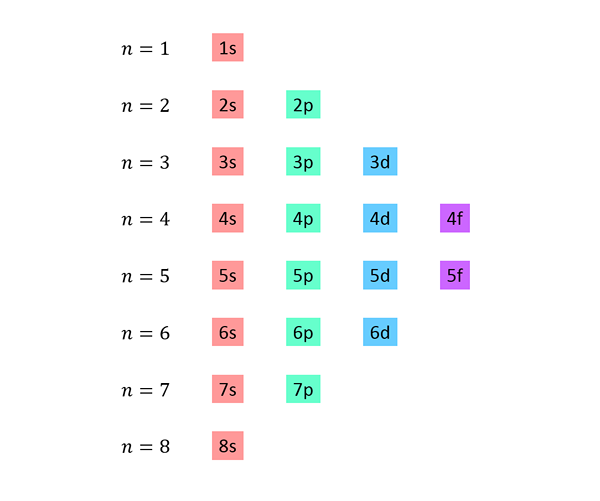
Er wordt een lijst gemaakt waarin elke lijn overeenkomt met een energieniveau en de een na de ander bevat, alle sub -niveaus beschikbaar op dat energieniveau.
De eerste regel komt bijvoorbeeld overeen met niveau 1 (n = 1) en bevat alleen het 1s sub -niveau; De tweede regel komt overeen met niveau n = 2 en bevat 2s en 2p subniveau; De derde bevat de 3s, 3p en 3d sub -niveaus, enzovoort.
De complete lijst ziet er zo uit:
Stap 2
Dalende diagonalen worden van rechts naar links getekend, de ene onder de andere, zoals hieronder weergegeven.
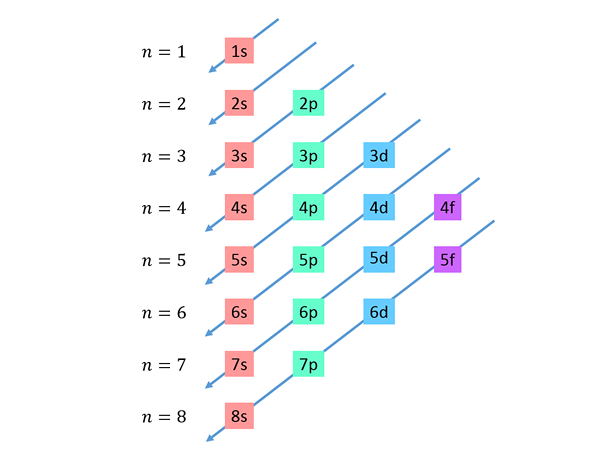
Deze lijnen lijken op de route van waterdruppels tijdens een wind met wind, dus deze grafiek wordt meestal "de regenmethode" genoemd. De vulvolgorde wordt bepaald door de volgorde waarin deze diagonalen de subniveau in de lijst raken.
Op basis van de vorige figuur is de volgorde van energie van de orbitalen en daarom de volgorde waarin ze moeten worden ingevuld, is:
Kan u van dienst zijn: kwantumtafel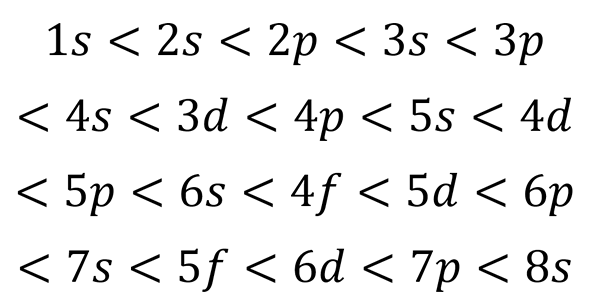
Deze vulvolgorde is de enige die er echt toe doet bij het schrijven van de elektronische configuratie van een atoom. Bij het vullen van deze sub -niveaus moet worden herinnerd dat in de sub -niveaus S Slechts 2 elektronen passen erin P Fit 6, in de D Ze passen 10 en in de F Ze passen 14.
Uitzonderingen aan het begin van Aufbau
Het AUFBAU -principe stelt duidelijk vast dat een subniveau niet kan worden gevuld totdat alle vorige subniveau volledig is gevuld. Er zijn echter enkele uitzonderingen op deze regel.
In sommige gevallen heeft het atoom liever een sub -niveau van energie dat precies in tweeën wordt gevuld dan een onvolledige te hebben die niet vol is in de helft. In die gevallen komt de werkelijke elektronische configuratie van het atoom niet overeen met de voorspelde volgorde door de regenmethode.
Volgens het AUFBAU -principe moet het chroomatoom bijvoorbeeld een elektronische configuratie hebben die eindigt in 4S2 3D4. De echte configuratie is echter 4s1 3D5 Omdat dus de 4S- en 3D -subniveau in de helft zijn gevuld, in de andere configuratie NO.
Hetzelfde geldt voor koper waarvan de configuratie eindigt in 4s1 3D10, in plaats van 4s2 3D9, Omdat dus sub -level d en s vult en s vol is in de helft.
Voorbeelden van de toepassing van het AUFBAU -principe
Vervolgens zijn er 5 voorbeelden van elementen die voldoen aan het AUFBAU -principe:
Voorbeeld 1: Natriumelektronische configuratie
Natrium is element 11, dus het heeft 11 protonen en 11 elektronen. De elektronische configuratie is 1s2 2s2 2 p6 3S1.
Voorbeeld 2: Argon elektronische configuratie
Argon (AR) is element 18, dus het heeft 18 protonen en 18 elektronen. De elektronische configuratie is daarom 1s2 2s2 2 p6 3S23P6. Het is te zien dat zijn sub -niveaus en P -sub -niveaus volledig waren.
Kan u van dienst zijn: propyleen (C3H6)Voorbeeld 3: Elektronische galliumconfiguratie
Gallium (GA) is element 31, dus het heeft 31 protonen en 31 elektronen. De elektronische configuratie is 1s2 2s2 2 p6 3S23P64S23D104P1.
Dit kan op een samenvattende manier worden geschreven als [ar] 4s23D104P1, waarbij [ar] de elektronische argonconfiguratie weergeeft die in het vorige voorbeeld wordt gepresenteerd.
Voorbeeld 4: Elektronische koolstofconfiguratie
Koolstof (C) is element 6, dus het heeft 6 protonen en 6 elektronen. De elektronische configuratie is 1s2 2s2 2 p2.
Voorbeeld 5: Elektronische chloorconfiguratie
Chloor (CL) is element 17. De 17 elektronen worden verdeeld volgens de volgende elektronische configuratie: 1s2 2s2 2 p6 3S23P5 of [ne] 3s23P5.
Aanvullende voorbeelden van uitzonderingen aan het begin van AUFBAU
Vervolgens zijn er 2 aanvullende voorbeelden van elementen die het AUFBAU -principe schenden:
Voorbeeld 6: Molybdeen -elektronische configuratie
Molybdeum (mo) is element 42. De eerste 36 elektronen worden op dezelfde manier verdeeld als in de crypton, maar de valentie -elektronen volgen niet de normale volgorde. In plaats van elektronische configuratie [KR] 5S24d4, De configuratie is [KR] 5S14d5, Vergelijkbaar met wat er met Chrome gebeurt.
Voorbeeld 7: zilveren elektronische configuratie
La Plata (AG, element 47) presenteert een schending van het AUFBAU -principe vergelijkbaar met dat van koper. De elektronische configuratie is [KR] 5S14d10 In plaats van [Kr] 5s24d9.

