Octetregel

- 4248
- 1278
- Irving McClure I
 Weergave van een koolstofdioxidemolecuul dat de naleving van de octetregel aantoont
Weergave van een koolstofdioxidemolecuul dat de naleving van de octetregel aantoont Wat is de octetregel?
De Octetregel Het is een praktische regel die de vorming van de chemische binding van de representatieve elementen verklaart op basis van de elektronische configuratie van de valentielaag.
Volgens deze regel combineren de atomen zo met elkaar dat elk atoom is omgeven door acht elektronen in zijn valentielaag (vandaar het woord octet).
Deze regel werd tegelijkertijd gepubliceerd in 1.916 Zowel Gilbert Lewis als Walther Kossel. Het weerspiegelt de observatie dat nobele gassen zeer stabiel zijn en alles, met uitzondering van helium, worden ze gekenmerkt door hun valentielaag met 8 elektronen te hebben.
De theorie stelt vast dat atomen elektronen delen of uitwisselen door chemische obligaties te vormen, om deze volledige elektronische configuratie van de lagen te verwerven.
De octetregel en Lewis -structuren
De octetregel en Lewis -structuren zijn nauw verwant. Dit komt omdat de octetregel een van de bases is om de vorming van de chemische binding te begrijpen, dus het maakt het mogelijk om in de meeste gevallen de Lewis -structuur van chemicaliën te voorspellen.
In die zin is een van de essentiële stappen om een Lewis -structuur te trekken, na het plaatsen van eenvoudige verbanden tussen alle atomen die het molecuul vormen, het verspreiden van de resterende valentie -elektronen over de meest elektronegatieve atomen om hun octetten te voltooien.
In gevallen waarin octetten zonder vullen zijn, worden dubbele of drievoudige bindingen gevormd, altijd op zoek naar de octetregel voor zoveel mogelijk atomen. Deze empirische regel is dus essentieel voor de constructie van Lewis -structuren.
Het kan u van dienst zijn: Silver Yoduro (AGI): structuur, eigenschappen, verkrijgen, gebruikVoorbeelden van naleving van de octetregel
De octetregel wordt voornamelijk toegepast op de representatieve elementen, dat wil zeggen op die van de S- en P -blokken van het periodiek systeem. Deze regel wordt consequent toegepast op verbindingen die koolstof, stikstof, zuurstof en halogenen bevatten, en met enkele uitzonderingen op de andere elementen van het P -blok. De meeste overgangsmetalen voldoen echter niet.
Enkele voorbeelden van verbindingen waarin de octetregel is vervuld voor alle atomen zijn:
Koolstofdioxide (CO2))
Zoals te zien is in de Lewis -structuur van de hieronder gepresenteerde koolstofdioxide, voldoen zowel de centrale koolstof als beide zuurstofatomen aan de octetregel.
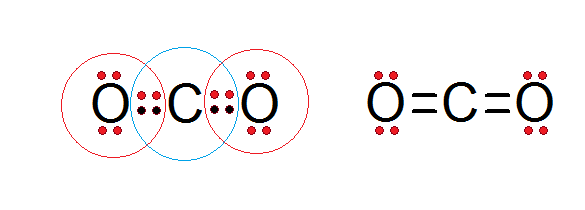
Koolstof wordt omgeven door zijn 4 valentie -elektronen, plus twee elektronen uit elke zuurstof, die bijdragen aan het vormen van de dubbele bindingen C = O, terwijl elke zuurstof is omgeven door 6 eigen elektronen plus een paar uit koolstof.
Neopentano (C5H12))
In de overgrote meerderheid van organische verbindingen vervullen alle atomen de octetregel (behalve voor waterstof die wordt omgeven door slechts 2 elektronen). Dit omvat alkanen zoals Neopentano of 2.2-dimethylpropaan:
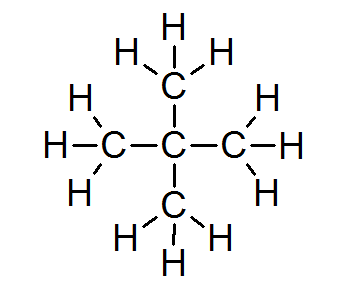
In dit geval is ook te zien dat elk koolstofatoom zijn vier elektronen deelt met 4 aangrenzende atomen, die elk een van zijn elektronen levert om de 4 eenvoudige covalente bindingen te vormen die bij elkaar blijven.
Om deze reden wordt elk koolstofatoom omgeven door 8 valentie -elektronen, wat voldoet aan de octetregel.
Kan u van dienst zijn: activeringsenergieKoolmonoxide (CO)
Koolmonoxide is een andere moleculaire verbinding waarin zuurstof- en koolstof -elektronen een covalente binding vormen om te voldoen aan de octetregel.
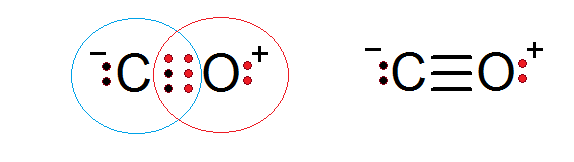
In dit geval biedt koolstof twee elektronen en zuurstof 4 om de 6 elektronen te voltooien die nodig zijn om de drievoudige covalente binding te vormen die hen verenigt. Elk van de twee atomen heeft extra elektronen zonder dat te delen die elk octet voltooien.
Nitraatanion (nee3-))
Ook in het geval van ionen wordt de octetregel vervuld. Het nitraation heeft een centraal stikstofatoom omgeven door 3 zuurstofatomen.
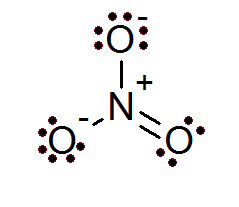
Zoals in dit geval te zien is, hebben alle atomen hun volledige octet, twee van de zuurstof hebben een negatieve formele belasting, terwijl stikstof een positieve formele belasting heeft, wat resulteert in de netto belasting van -1 nitraation.
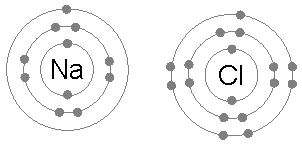
Natriumchloride (NaCl)
De uitwisseling van elektronen om ionische verbindingen te vormen, is ook een veel voorkomend voorbeeld van de toepassing van de octetregel.
Wanneer natriumchloride wordt gevormd uit chloor en natrium, begint het bij twee atomen die niet voldoen aan de octetregel, omdat natrium op een elektron en chloor er een mist om zijn octet te voltooien.
Vervolgens geeft het natrium zijn elektron aan chloor, waardoor het kation wordt omringd door 8 elektronen en op zijn beurt het octet aan het chloor voltooit door het chloride -ion te vormen.
 Uitzonderingen op de octetregel
Uitzonderingen op de octetregel
Net zoals er een groot aantal verbindingen zijn waarin alle atomen de octetregel vervullen, zijn er ook meerdere voorbeelden van atomen die er niet aan voldoen.
Het kan u van dienst zijn: potentiële Z: waarden, coagulatiegraden, vastberadenheid, gebruikSommigen zijn omgeven door minder dan 8 elektronen, dus dat zijn ze Slechte elektronsoorten, terwijl anderen worden omringd door meer dan acht elektronen, in welk geval wordt gezegd dat het een uitgebreid octet heeft of wordt gebeld Hypervalent atoom.
Voorbeelden van slechte elektronsoorten
Bordean (BH3))
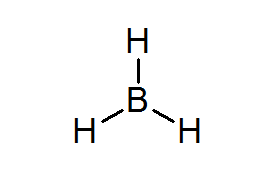
Deze verbinding is een typisch voorbeeld van een slecht soort elektronen. Noch Boron noch de omliggende hydrogenen hebben voldoende elektronen om de octetregel in het centrale atoom te bevredigen. Dit zorgt ervoor dat Boron een paar elektronen van een ander atoom in een ander molecuul ontvangt, waardoor het bordeal in een zuur van Lewis verandert.
Aluminium triclurur (alcl3))
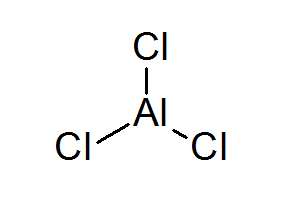
De alcl3 Het is een ander voorbeeld van een Lewis -zuur dat zijn chemische gedrag verschuldigd is waaraan het niet aan de octetregel voldoet.
Voorbeelden van hypervaluent soorten
Zwavel hexafluoruro (sf6))
Een typisch voorbeeld van een uitgebreid octet is de SF6, die meestal wordt weergegeven als een centrale zwavel met 6 eenvoudige covalente bindingen met fluoratomen. In dit geval wordt zwavel omgeven door 12 valentie -elektronen in plaats van 8, dus het schendt de octetregel.
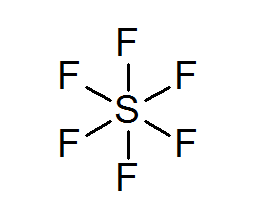
Desondanks zijn modellen voorgesteld waarin zwavel daadwerkelijk is gekoppeld aan covalente bindingen aan 4 fluors tegelijkertijd, terwijl met de andere twee, gevormde ionische bindingen. Als dat zo is, zou het de octetregel vervullen.
Fosfor pentachloride (pcl5))
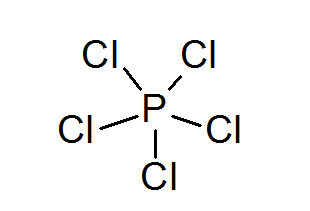
Zoals in het geval van zwavel, kan fosfor ook verbindingen vormen met uitgebreide octetten, in dit geval omgeven door 10 elektronen.

