Elektronische affiniteit

- 1014
- 103
- Cecil Graham
Wat is elektronische affiniteit?
De Elektronische affiniteit Het wordt gedefinieerd als de hoeveelheid energie die vrijkomt wanneer een mol atomen in gasvorming wordt gecombineerd met een mol elektronen om een mol anionen te vormen, ook in een gasvormige toestand. Met andere woorden, het verwijst naar het negatieve van de enthalpie -variatie van het volgende proces:
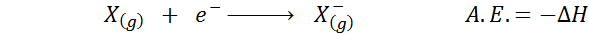
Zoals de naam al aangeeft, elektronische affiniteit (a.EN.) Het is een maat voor de trend die een atoom heeft om zich bij een elektron aan te sluiten. Dat wil zeggen, het meet de affiniteit van een atoom voor elektronen.
Interpretatie van elektronische affiniteit
Vanwege de manier waarop het wordt gedefinieerd, houdt een hoge elektronische affiniteit in dat enthalpie variatie erg negatief is. Dit geeft op zijn beurt aan dat het proces energetisch gunstig is en dat de producten stabieler zijn dan de reagentia. Om deze reden zouden we ook kunnen zeggen dat elektronische affiniteit een indirecte maat is voor de stabiliteit van een anion.
Hoe groter de elektronische affiniteit van een atoom, hoe groter de trend om het anion te vormen. Dit is de reden waarom atomen zoals chloor, waarvan de elektronische affiniteit 349 kJ/mol is, de neiging hebben om gemakkelijk anionen te vormen (in dit geval chloride -anion), terwijl andere atomen zoals magnesium, waarvan de elektronische affiniteit negatief is, geen anionen vormen.
Verduidelijking over elektronische affiniteit en ionisatie -energie
Vaak denk je aan elektronische affiniteit als het tegenovergestelde van ionisatie -energie (de neiging van een gasvormige atoom om een elektron te verliezen), maar dit is niet zo. Beschouw bijvoorbeeld een atoom X.
Het kan u van dienst zijn: Tusfrano: chemische structuur, eigenschappen en gebruikDe elektronische affiniteit verwijst naar de verandering van energie van het hierboven getoonde proces in de eerste vergelijking. De ionisatie -energie verwijst echter naar de verandering van energie wanneer het atoom een elektron verliest:
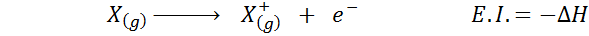
Hoewel deze reactie de tegenovergestelde reactie op de vorige lijkt te zijn.
Wat bepaalt elektronische affiniteit?
Om te weten welke kenmerken van een atoom de waarde van zijn elektronische affiniteit beïnvloeden, moet de stabiliteit van het oorspronkelijke atoom worden overwogen, evenals die van het gevormde anion. Als het anion stabieler is dan het atoom, dan zal de elektronische affiniteit hoog zijn, anders zal het laag of zelfs negatief zijn.
Maar hoe te weten welke van de twee soorten stabieler is? Daarvoor vertrouwen we op twee factoren:
- Elektronische configuratie. Er zijn stabielere elektronische instellingen dan andere. Over het algemeen is de volledige laagconfiguratie (zoals edelgassen) de meest stabiele van allemaal. Vervolgens wordt het gevolgd door de semi-Lena-laagconfiguratie, waarin alle orbitalen van de Valencia-laag de helft van de elektronen hebben die ze zouden kunnen hebben (bijvoorbeeld 4s14P3)).
- Elektronische afstoting. Als een belastinganion -1 wordt vergeleken, met een belastinganion -2, zal er in het tweede geval veel meer afstoting zijn tussen elektronen, die anion destabiliseert.
Periodieke neiging van elektronische affiniteit
 Grafiek met de elektronische affiniteiten van de eerste 9 elementen van het periodiek systeem
Grafiek met de elektronische affiniteiten van de eerste 9 elementen van het periodiek systeem Elektronische affiniteit is een van de periodieke eigenschappen van de elementen. Dat wil zeggen, het is een eigenschap die voorspelbaar varieert van het ene element tot het andere, afhankelijk van zijn positie in het periodiek systeem. In het algemeen neemt de elektronische affiniteit toe naarmate de atoomgrootte afneemt.
Het kan u van dienst zijn: semi -ontwikkelde formule: wat is en voorbeelden (methaan, propaan, butaan ...)In die zin varieert de grootte van de atomen afhankelijk van de periode en de groep waarin deze zich bevindt, dus de elektronische affiniteit varieert ook zoals hieronder uitgelegd:
Variatie van elektronische affiniteit gedurende een periode
Althans voor de representatieve elementen (die behoren tot de S- en P -blokken van de periodiek systeem), kan worden waargenomen dat de elektronische affiniteit een algemene neiging heeft om van links naar rechts te toenemen, vanwege de toename van de effectieve nucleaire belasting die is in staat om elektronen met een grotere kracht aan te trekken.
Als we bijvoorbeeld de 3e periode van het periodiek systeem nemen, kunnen we zien dat de elektronische affiniteit van de Li (60 kJ/mol) minder is dan die van zuurstof (141 kJ/mol) en dit is minder dan die van fluoride (328 kJ /mol).
Uitzonderingen
De vorige regel is niet altijd vervuld.
Ten eerste, wanneer ze van alkalische metalen naar alkaliners gaan, neemt de elektronische affiniteit af. Dit komt omdat voor alkalische metalen (NS elektronische configuratie1) Het is gunstig om een elektron te vangen, omdat ze zouden afmaken met het vullen van hun orbitale s.
In het geval van alkalineros (elektronische configuratie NS2) Het vastleggen van een elektron is ongunstig omdat ze al hun volledige baan hebben. Hetzelfde gebeurt bij het verplaatsen van halogenen (die de elektronische affiniteiten van alle elementen hebben) naar de edelgassen.
Variatie van elektronische affiniteit in een groep
In het geval van groepen is gedrag nog minder voorspelbaar. De algemene regel is dat de a.EN. neemt toe vanaf de onderkant omhoog, in dezelfde richting die de atoomradius vermindert. Voor alkalische en halogeenmetalen wordt deze regel vrij goed vervuld. Dit gebeurt echter niet met de meeste andere groepen.
Kan u van dienst zijn: kobalthydroxideVoorbeelden van elektronische affiniteit van sommige representatieve elementen
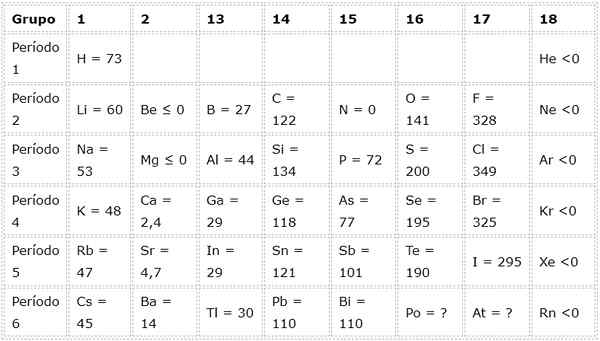
De volgende tabel toont elektronische affiniteitswaarden in (kj/mol) van De representatieve elementen Gesorteerd op groep:
Hieronder staan enkele voorbeelden van elektronische affiniteit samen met de reactie waarnaar ze verwijzen:
1. Waterstof elektronische affiniteit
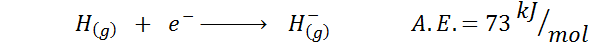
2. Elektronische zuurstofaffiniteit
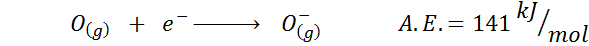
3. Anion elektronische affiniteit
Een ander veel voorkomend voorbeeld is het geval van elektronische affiniteit van een anion zoals of-. De A.EN. In dit geval wordt het gegeven door de energie die is gekoppeld aan het volgende proces:
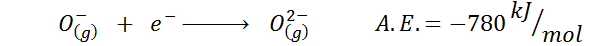
Zoals te zien is, is deze elektronische affiniteit sterk negatief, hoewel het ion of2- Het heeft de elektronische neonconfiguratie (een edelgas) en van een veel voorkomende ion in veel ionische vaste stoffen.
De reden is dat de afstoting van negatieve ladingen in de OK2- destabiliseert dit gasvormige toestandion, maar in de vaste toestand wordt de belasting gestabiliseerd door de kationen eromheen.

