Pepsinogeenstructuur, functies, typen, synthese
- 2524
- 614
- Aaron Okuneva
Hij Pepsinogeen Het is het zimogeen van het pepsine, een van de belangrijkste hydrolytische enzymen die de leiding geven aan het uitvoeren van eiwitvertering in de maag van zoogdieren. Zimogenen of pro -enzymen zijn inactieve enzymatische voorlopers, dat wil zeggen dat ze niet in staat zijn om de reacties te katalyseren die worden uitgevoerd door hun actieve vormen.
De activering ervan hangt af van veranderingen in de drie -dimensionale structuur van het eiwit die aanleiding geven tot de vorming van een functionele actieve site. Deze veranderingen vallen in de meeste gevallen samen met de proteolytische breuk van een eiwitsegment.
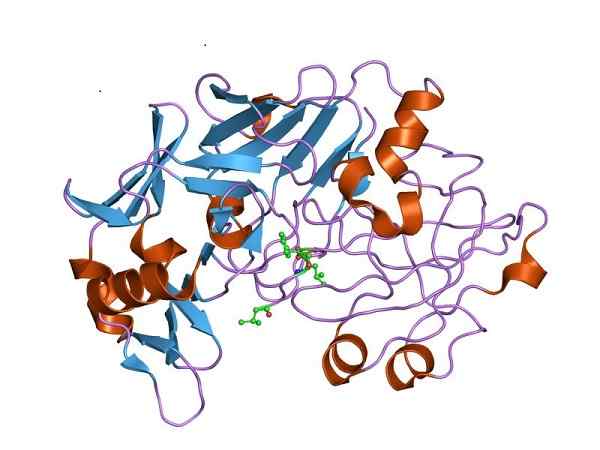
 Drie -dimensionale structuur van pepsine, de katalytisch actieve vorm van pepsinogeen. Door Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons
Drie -dimensionale structuur van pepsine, de katalytisch actieve vorm van pepsinogeen. Door Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons Daarom moet pepsinogeen structurele veranderingen ervaren om de vereiste peptidase -activiteit te verwerven en de voorkeur te geven aan eiwitvertering in de maag, na voedselinname.
[TOC]
Structuur
Pepsinogeen is een 371 aminozuureiwit dat behoort tot de grote familie van aspartische proteïnasen, gekenmerkt door het presenteren van asparaginezuurresiduen in zijn actieve centrum.
De quaternaire structuur werd voor het eerst bepaald voor het eiwit tot expressie gebracht in varkens via de X -Ray Crystallography Techniek. Het resultaat was vergelijkbaar met die getoond door de volwassen of actieve vorm van het eiwit, het pepsine.
Het enige gevonden verschil is dus de aanwezigheid in het pepsinogeen van een 44 aminozuurpeptide dat over de spleet van de actieve plaats vouwt. In deze positie belemmert het de interactie van dit protease met afgebroken eiwitten.
Dit peptide dat zal worden vastgehouden om aanleiding te geven tot het actieve enzym, bevindt zich aan het amino -terminale uiteinde van het eiwit.
Omdat het alleen als een dop werkt, is het onvermogen van het afgebroken eiwitpepsinogeen niet te wijten aan structurele vervormingen van het actieve centrum. Integendeel, dit blijft met dezelfde conformatie in beide vormen van de enzym.
Kan u van dienst zijn: glucans: structuur, kenmerken en functiesIn deze zin is het vermeldenswaard dat de kristalstructuur van het pepsinogeen een geschat model vormt van de structuur van andere zimogenos die behoren tot de grote familie van aspartische eiwitten.
Functie
Aan het begin van het leven is pepsine (actieve vorm van pepsinogeen) belangrijk voor de spijsvertering van de melk. Vervolgens is de functie ervan om dieetproteïnen in hun bestanddelen (aminozuren) af te breken om hun gemakkelijke absorptie te vergemakkelijken.
Synthese en secretie
Pepsinogeen wordt gesynthetiseerd door de hoofdcellen en fondsencellen van het maagslijmvlies. Vervolgens wordt het opgeslagen in secretoire blaasjes die in het cytoplasma van deze cellen blijven tot het moment waarop hun afgifte vereist is.
Daarom is de secretie van dit zimogeen een proces dat wordt gereguleerd. De afgifte van blaasjes, inwoners van cytosol door exocytose, vereist hormonale en neurale stimuli. De toename van de niveaus van maag -enzymen scheiden en maag, evenals acetylcholine, cholecystoquinine, epidermale groeifactor en stikstofmonoxide stimuleren hun synthese en secretie.
Bovendien hebben experimenten uitgevoerd met ATT20 -cellen, een cellijn die gewoonlijk wordt gebruikt in de studie van secretieswegen bij zoogdieren, aangetoond dat een toename van cyclische AMP ook in staat is om een dergelijk secretie te induceren.
Naast zijn normale secretie op maagniveau, is een relatief lage hoeveelheid pepsinogeen gedetecteerd in zowel bloed als urine, daarom wordt het uropepsinogeen genoemd.
De oorsprong van het uropepsinogeen, evenals de functie die het op beide locaties kan uitvoeren, blijft zonder te worden bepaald. Hun afwezigheid bij patiënten die de maag volledig hebben verwijderd, lijkt echter aan te geven dat hun oorsprong even maag is.
Jongens
Tot nu toe zijn twee hoofdtypen pepsinogeen beschreven: pepsinogeen I en pepsinogeen II. Beide typen vertonen geen verschillen in hun katalytische activiteit en worden gelijkelijk geactiveerd door proteolytische hydrolyse afhankelijk van zoutzuur.
Kan u van dienst zijn: eiwit denaturatie: wat is, factoren, gevolgenPepsinogeen I wordt gesynthetiseerd en gescheiden door zowel de hoofdcellen als door de fondsencellen van het maagslijmvlies. Daarom neemt de secretie af bij patiënten met atrofische chronische gastritis, een maagziekte die wordt gekenmerkt door de totale verdwijning van maagklieren.
In tegenstelling tot het laatste, wordt pepsinogeen II (PGII) gesynthetiseerd door vrijwel alle cellen die deel uitmaken van het maagslijmvlies, maar meer prominenter door die van het antrale slijmvlies en die die de Brünner -klieren vormen in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn in de duodenum die aanwezig zijn.
Bij patiënten met atrofische chronische gastritis compenseert dit type pepsinogeen voor afname van pepsinogeen secretie I.
Het bestaan van deze twee soorten pepsinogeen, die alleen verschillen door te worden uitgescheiden door verschillende cellen, lijkt misschien overbodig. Het kan echter een evolutionaire aanpassing zijn om pepsinesynthese te garanderen wanneer nodig.
Activering
Pepsinogeen verwerft katalytische activiteit wanneer omgezet in pepsine, product van de eliminatie van het 44 aminozuurpeptide aanwezig in de actieve locatieholte.
De optimale bewerking is afhankelijk van lage pH -waarden opgenomen in het bereik van 1,5 tot 2. In fysiologische omstandigheden worden deze waarden gehandhaafd door de secretie van zoutzuur in intracellulaire kanalen.
Zure spijsvertering op maagniveau vindt niet plaats bij alle dieren, een voorbeeld hiervan zijn insecten, die geen pepsinogeen hebben. Gewervelde dieren die een maag hebben als ze maag activiteit hebben.
Pepsinogeen, dat wordt opgeslagen in de secretoire blaasjes van de hoofdcellen, wordt indien nodig vrijgegeven aan het maagkanaal. Zodra het maag bereikt, wordt het pepsineproduct van de zure omgeving en deze actieve meer pepsinogene moleculen.
Door werking van intrinsieke zenuwvezels en vagale extrinsieke stimulatie, wordt de productie van pepsinogeen gestimuleerd, evenals HCl, gastrine en histamine. Aan de andere kant stimuleren histamine en maagpariëtale cellen om HCl uit te scheiden.
Kan u van dienst zijn: Geleidingsstoffen: wat is, kenmerken, functiesPepsine werkt, net als alle endopeptidase, op specifieke verbanden tussen eiwitaminozuren om kleinere peptiden te genereren.
Met andere woorden; Hydrolyseert de interne peptidebindingen van een eiwit. De werking ervan is effectiever in peptideverbindingen dicht bij aromatische aminozuren (fenylalanine, tyrosine). In tegenstelling tot zijn voorloper zimogeen, produceren de adaptieve veranderingen van de pepsine in pH -waarden groter dan 6 onomkeerbare dalingen van katalytische activiteit.
Referenties
- Bryksa BC, Tanaka T, Yada Ry. N-terminale modificatie verhoogt de neutrale pH-stabiliteit van pepsine. Biochemie. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Vergelijking van de primaire structuren van zure protessa en hun zymogenen. Adv exp med Biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Textbook of Medical Phisiology. (11e ed.)). VS: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, principes van interne geneeskunde. (16e ed.)). Mexico: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino Ma. Ernstige atrofische gastritis met Helicobacter pylori -infectie en maagkanker. Maagkanker. 1998; 1: 118-124.
- Lin Y, gevonden M, Lin X, Hartsuck JA, Tang J. PH-afhankelijkheid van kinetische parameters van pepsine, rhizopuspepsine en hun waterstofbruggen van actieve plaats mutanten. J Biol Chem. 1992; 267: 18413-18418.
- Mangeat P. Zure secretie en membraanreorganitatie in enkele maagpariëtale cel in de primaire kweek. Biologiecel. 1990; 69: 223-257.
- Prozialeck J, Wershil Bk. (2017). Ontwikkeling van maagsecretorische functie. Foetale en neonatale fysiologie (vijfde editie). Deel 1, pagina's 881-888.
- Schubert ML. Maaggeheim. Huidige opinie Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. De moleculaire en kristalstructuren van monoklinisch varkens pepsine verfijnd bij 1.8 Å resolutie. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. De epidemiologie van lage serumpepsinogeen A -niveaus en een internationale associatie met maagkankerpercentages. Gastro -enterologie. 1994; 107: 1335-1344.
- Wolfe mm, soll ah. De fysiologie van maagzuurgeheim. N English J Med 1998; 319: 1707.
- « G -cellenontwikkeling, Gastrine, typosable kanalen veen
- Nanche -kenmerken, habitat, eigenschappen, kookrecepten »

