OxiHemoglobin -kenmerken, structuur en junctie curve
- 1068
- 6
- Nathan Wiegand
OFXihemoglobine Het is de naam die hemoglobine ontvangt wanneer het aansluit bij zuurstof. Hemoglobine is een eiwit dat zich binnen de rode bloedcellen bevindt en waarvan de belangrijkste functie is om zuurstof van de longen naar de weefsels te transporteren.
De eerste levende wezens waren eencellig en leefden in een vloeibare atmosfeer waaruit ze werden gevoed en waarvoor ze hun afval elimineerden, evenals enkele van de organismen die momenteel bestaan. Onder deze omstandigheden worden deze processen bereikt door eenvoudige verspreidingsmechanismen, omdat de celwand in intiem contact heeft met het medium dat het levert.
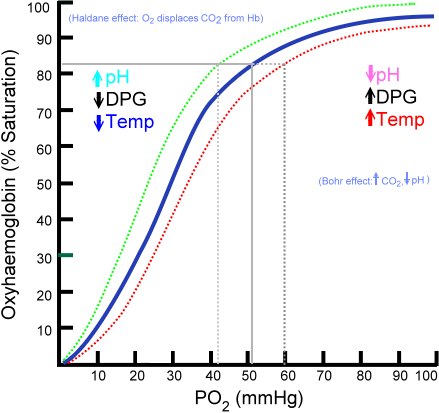
 Dissociatiecurve van de oxihemoglobine (bron: ratznium bij Engelse wikipedialat -versies werden geüpload door Aaronsharpe.Wikipedia. [Public Domain] Via Wikimedia Commons)
Dissociatiecurve van de oxihemoglobine (bron: ratznium bij Engelse wikipedialat -versies werden geüpload door Aaronsharpe.Wikipedia. [Public Domain] Via Wikimedia Commons) De ontwikkeling van steeds complexere pluricellulaire organismen impliceerde dat interne cellen aanzienlijk van de omgeving werden weggegaan, dus de verspreidingsmechanismen naarmate de enige bron van levering onvoldoende werd.
Aldus werden gespecialiseerde systemen ontwikkeld om voedingsstoffen en gassen zoals het spijsverteringssysteem en het ademhalingssysteem te verkrijgen, evenals transportmechanismen om deze voedingsstoffen en gassen naar de cel te brengen: het cardiovasculaire systeem.
Om energie te produceren in de vorm van ATP -moleculen, hebben cellen zuurstof nodig. Gezien het feit dat de ATP niet kan worden opgeslagen, moet deze constant worden gesynthetiseerd, wat een permanente vraag naar zuurstof door cellen betekent.
Hemoglobine ontstond, evolutionair gesproken, als een gastransporter dat het probleem van zuurstoftransport van het milieu naar de cel "oplost".
[TOC]
Kenmerken en structuur
Om te praten over de kenmerken en structuur van oxyhemoglobine is het noodzakelijk om te verwijzen naar hemoglobine, omdat oxyhemoglobine niets meer is dan zuurstof hemoglobine. Daarom zullen vanaf nu de gewrichtseigenschappen van het molecuul in aanwezigheid of niet van het betreffende gas worden beschreven.
Waar is hemoglobine voor?
Hemoglobine is nodig om zuurstof naar de weefsels te transporteren in de hoeveelheid en snelheid die ze verdienen, gezien het feit dat zuurstof zo weinig oplosbaarheid in de bloed heeft dat het diffusietransport onvoldoende zou zijn om weefselbehoeften te voorzien.
Kan u van dienst zijn: bewijzen van de evolutie van levende wezensHoe is een hemoglobinemolecuul?
Hemoglobine is een tetrameer eiwit (dat vier subeenheden heeft), heeft een bolvormige vorm en een moleculaire massa van 64 kDa.
De vier subeenheden vormen een enkele functionele eenheid, waarbij de een wederzijds de andere beïnvloedt. Elke subeenheid bestaat uit een polypeptideketen, globine en een prothetische groep, de Hemo- of "Hem" -groep, die fungeert als een cofactor en niet wordt gevormd door aminozuren; dat wil zeggen, het is geen eiwit natuur.
Globin is op twee manieren: Alpha Globin en Beta Globin. De hemoglobine -tetrameer bestaat uit een paar alpha -globineketens (141 aminozuren) en een paar bèta -globineketens (146 aminozuren).
Elk van de vier polypeptideketens is gekoppeld aan een Hemo -groep, die een ijzeratoom heeft in een ferreuze toestand (Fe2+) in het midden.
Hoe is de Hemo -groep?
De Hemo -groep is een porfyrine -ring die wordt gevormd door vier pyrrolische ringen (heterocyclische aromatische verbindingen met de formule C4H5N) verenigd door methylbruggen. Het ijzer in ijzerstaat in het midden is onderworpen aan de structuur door gecoördineerde stikstofverbindingen.
Elke HEMO -groep is in staat om een zuurstofmolecuul aan te sluiten, zodat elk hemoglobinemolecuul slechts 4 gasmoleculen kan verbinden.
Het menselijk lichaam bevat ongeveer 2,5 x 1013 erytrocyten, de bloedcellen die hemoglobine produceren en transporteren. Elke erytrocyt heeft ongeveer 280 miljoen hemoglobinemoleculen en kan vervolgens meer dan 1000 miljoen zuurstofmoleculen vervoeren.
Kan u van dienst zijn: aspectenproces: kenmerken en fasenHoe wordt oxyhemoglobine gevormd?
Oxihemoglobine wordt gevormd na de vereniging van een zuurstofatoom voor elk ijzeratoom van ijzer die in elke hemo -groep van het hemoglobinemolecuul vindt.
De term oxihemoglobine verwijst vervolgens naar een geoxygeneerde en niet chemisch geoxideerd hemoglobine, omdat het geen elektron verliest in combinatie met zuurstof en ijzer blijft in ijzerstaat.
Oxygenatie produceert een verandering in de quaternaire structuur van het molecuul, dat wil zeggen een verandering in conformatie die kan worden overgedragen van de globineketens naar de Hemo en vice versa -groep.
Wat is de maximale hoeveelheid zuurstof die hemoglobine kan laden?
Hemoglobine kan hoogstens vier zuurstofmoleculen in zijn structuur verbinden. Als het molaire volume van ideale gassen 22 is.4 l/mol, één mol hemoglobine (64.500 g) zal meedoen met 89.6 liter zuurstof (4 mol O2 x 22.4 l/mol).
Dus elke gram hemoglobine moet meedoen 1.39 ml O2 is 100% verzadigd (89.6L/64500G X (1000 ml/L)).
In de praktijk vertonen bloedtests iets lagere resultaten, omdat er kleine hoeveelheden methemoglobine (geoxideerd hemoglobine) en carboxyhemoglobine (hemoglobine + koolmonoxide (CO)) zijn die geen zuurstof kunnen aansluiten.
Hiermee rekening gehouden.34 ml.
Oxyhemoglobine -bindcurve
De hoeveelheid zuurstofmoleculen die kunnen worden verbonden met een hemoglobinemolecuul hangt af van de gedeeltelijke zuurstofdruk of PO2. Bij afwezigheid van zuurstof wordt hemoglobine gedeoxygeneerd, maar naarmate PO2 toeneemt, neemt het aantal zuurstof dat bindt aan hemoglobine toe.
Het zuurstofbindingsproces aan hemoglobine afhankelijk van gedeeltelijke zuurstofdruk. Bij het grafiek wordt het resultaat "oxihemoglobinecurve" genoemd en heeft het een karakteristieke vorm van 's' of sigmoid.
Kan u van dienst zijn: taxismeAfhankelijk van de PO2 zal hemoglobine in een kleinere of grotere capaciteit verkeren om de zuurstof die het transporteert te "los te maken" of "te leveren", en hiermee te laden.
In het gebied tussen 10 en 60 mmHg druk krijgt u bijvoorbeeld het onderdeel met meer in afwachting van de curve. In deze toestand kan hemoglobine gemakkelijk grote hoeveelheden O2 opleveren. Dit is de voorwaarde die in de weefsels wordt bereikt.
Wanneer PO2 tussen 90 en 100 mmHg (12 tot 13 kPa) ligt, is hemoglobine bijna 100% verzadigd met O2; En wanneer het arteriële PO2 60 mmHg (8 kPa) is, is de verzadiging met O2 nog steeds zo hoog als 90%.
In de longen zijn dit de omstandigheden die overheersen (druk tussen 60 en 100 mmHg), en dit is dat hemoglobinemoleculen in erytrocyten mogelijk maken.
Deze sigmoïde vorm die de oxihemoglobine -curve trekt, zorgt ervoor dat dit eiwit zich gedraagt als een uitstekende lader op het longniveau, een zeer efficiënte transportbeurt in de bloeddruk en een uitstekende O2 -donor in de weefsels, in verhouding tot de lokale metabole snelheid, dat wil zeggen, te eisen.
Referenties
- Fox, s. Je. (2006). Menselijke fysiologie 9e editie (PP. 501-502). McGraw-Hill Press, New York, VS.
- Murray, r. K., Granner, D. K., Mayes, p. NAAR., & Rodwell, V. W. (2014). Harper's geïllustreerde biochemie. McGraw-Hill.
- Rawn, J. D. (1998). Biochemistry (1989). Burlington, North Carolina: Neil Patterson Publishers (c) n. Lalioti, CP Raptopoulou, een. Terzis, a. Panagiotopoulos, sp perlepes, en. Manessi-zouopa, j. Chem. SOC. Dalton Trans, 1327.
- Robert M. Berne, Matthew n. Heffing. (2001) Fysiologie. (3e ed.) Harcourt -edities, s.NAAR.
- West, J. B. (1991). Fysiologische basis van de medische praktijk. Williams & Wilkins
- « Erytropoietin (EPO) kenmerken, productie, functies
- Dystrofine -eigenschappen, structuur en functies »

