Zuurstofeigenschappen, structuur, risico's, gebruik

- 4042
- 874
- Pete Heaney V
Hij zuurstof Het is een chemisch element dat wordt weergegeven door het symbool of. Het is een zeer reactief gas, dat groep 16 leidt: de calcogen. Deze naam is omdat zwavel en zuurstof aanwezig zijn in bijna alle mineralen.
De hoge elektronegativiteit verklaart zijn grote aviditeit door elektronen, wat leidt tot combinatie met een groot aantal elementen; Dit is hoe een breed scala aan minerale oxiden ontstaat die de aardkorst verrijkt. Aldus componeert de resterende zuurstof en maakt de atmosfeer ademend.
 Zuurstof is meestal synoniem met lucht en water, maar het wordt ook gevonden in rotsen en mineralen. Bron: Pxhere.
Zuurstof is meestal synoniem met lucht en water, maar het wordt ook gevonden in rotsen en mineralen. Bron: Pxhere. Zuurstof is het derde element in overvloed in het universum, achter waterstof en helium, en is ook het belangrijkste massa -bestanddeel van de cortex van de aarde. Het heeft een volumepercentage van 20,8% van de atmosfeer van de aarde en vertegenwoordigt 89% van de massa water.
Het heeft meestal twee allotrope vormen: diatomaire zuurstof (of2), wat de meest voorkomende manier is in de natuur, en ozon (of3), gevonden in de stratosfeer. Er zijn echter twee anderen (of4 I8) die bestaan in zijn vloeibare of vaste fasen, en onder enorme druk.
Zuurstof wordt constant geproduceerd via het fotosyntheseproces, uitgevoerd door fytoplankton en terrestrische planten. Eenmaal geproduceerd, wordt het zo vrijgegeven dat levende wezens het kunnen gebruiken, terwijl een klein deel ervan oplost in de zeeën, wat het waterleven ondersteunt.
Het is daarom een essentieel element voor levende wezens; Niet alleen omdat het aanwezig is in de meeste verbindingen en moleculen die ze vormen, maar ook ingrijpen in al hun metabole processen.
Hoewel controversieel zijn isolatie wordt toegeschreven aan Carl Scheele en Joseph Priestley in 1774, zijn er aanwijzingen dat zuurstof voor het eerst in 1608 werd geïsoleerd, door Michael Sendivogius.
Dit gas wordt in de medische praktijk gebruikt om de levensomstandigheden van patiënten met ademhalingsmoeilijkheden te verbeteren. Evenzo wordt zuurstof gebruikt om mensen in staat te stellen hun functies te vervullen in omgevingen waarin er verminderd is of geen toegang tot atmosferische zuurstof.
Commercieel geproduceerde zuurstof wordt voornamelijk gebruikt in de metallurgische industrie voor ijzerconversie naar staal.
[TOC]
Geschiedenis
Nitroariale geest
In 1500, Leonardo da Vinci, gebaseerd op de experimenten van Philo de Byzantium in de tweede eeuw tot. C., Hij concludeerde dat een deel van de lucht werd geconsumeerd tijdens verbranding en ademhaling.
In 1608 toonde Cornelius drebble aan dat verwarmingsruimte (zilvernitraat, kno3) Er is een gas opgetreden. Dit gas was, zoals het later bekend zou zijn, zuurstof; Maar drebble kon het niet identificeren als een nieuw element.
Toen, in 1668, wees John Majow erop dat een deel van de lucht die hij "Spiritus Nitroaerus" noemde, verantwoordelijk was voor vuur, en dat het ook werd geconsumeerd tijdens het ademen en verbranden van stoffen. Majow merkte op dat stoffen niet hebben geregeld in afwezigheid van de nitroariale geest.
Majoow voerde de antimoonverbranding uit en observeerde een toename van het gewicht van het antimoon tijdens zijn verbranding. Toen concludeerde Majow dat de antimoon gecombineerd met de nitroariale geest.
Ontdekking
Hoewel hij geen erkenning kreeg van de wetenschappelijke gemeenschap, in het leven of na zijn dood, is Michael Sandivogius (1604) waarschijnlijk de ware ontdekker van zuurstof.
Sandivogius was een alchemist, filosoof en Zweedse arts die de thermische ontleding van kaliumnitraat produceerde. Zijn experimenten leidden hem tot de release van zuurstof, die hij "Cibus vitae" noemde: voedsel van het leven.
Tussen 1771 en 1772 verwarmde de Zweedse chemicus Carl W Scheele verschillende verbindingen: kaliumnitraat, mangaanoxide en kwikoxide. Scheele merkte op dat een gas dat de verbranding verhoogde, van hen werd vrijgegeven, en waaraan hij "vuurlucht" noemde.
Joseph priesterlijke experimenten
In 1774 verwarmde de Engelse chemicus Joseph Priestly kwikoxide door een vergrote lens met twaalf inch te gebruiken die zonlicht concentreerde. Kwikoxide gaf een gas vrij dat ervoor zorgde dat de kaars veel sneller verbrandde dan normaal.
Bovendien testte priester het biologische effect van gas. Om dit te doen, plaatste hij in een gesloten container een muis die hij verwachtte vijftien minuten te overleven; In aanwezigheid van gas overleefde hij echter een uur, meer dan hij schatte.
Priestly publiceerde zijn resultaten in 1774; Terwijl Scheele het deed in 1775. Om deze reden wordt de ontdekking van zuurstof aan priesterlijk toegeschreven.
Zuurstof in de lucht
Antoine Lavoisier, een Franse chemicus (1777), ontdekte dat de lucht 20% zuurstof bevat en dat wanneer een substantie brandt, deze eigenlijk combineert met zuurstof.
Lavoisier concludeerde dat de schijnbare gewichtstoename die stoffen ervaren tijdens de verbranding te wijten was aan het gewichtsverlies dat in de lucht plaatsvindt; Omdat zuurstof in combinatie met deze stoffen en daarom de massa's van de reactanten werden bewaard.
Hierdoor kon Lavoisier de wet van behoud van materie vaststellen. Lavoisier suggereerde de naam van zuurstof die uit de wortel "oxys" zuur en "genen" vorming kwam. Dan betekent zuurstof 'zuur voorheen'.
Deze naam is verkeerd, omdat niet alle zuren zuurstof bevatten; Bijvoorbeeld waterstofhalogeniden (HF, HCL, HBR en HI).
Dalton (1810) toegewezen aan het water de chemische formule ho en daarom was het atoomgewicht van zuurstof 8. Een groep chemicaliën, waaronder: Davy (1812) en Berzelius (1814) corrigeerden de aanpak van Dalton en concludeerden dat de juiste formule van het water h is h2O en het atoomgewicht van zuurstof is 16.
Kan u van dienst zijn: gedisioneerd waterFysische en chemische eigenschappen
Verschijning
Kleurloos, toilet en smakeloos gas; Terwijl ozone een hectare geur heeft. Zuurstof is voorstander van verbranding, maar op zichzelf is het geen brandstof.
 Vloeibare zuurstof. Bron: Staff Sgt. Nika Glover, u.S. Luchtmacht [Public Domain]
Vloeibare zuurstof. Bron: Staff Sgt. Nika Glover, u.S. Luchtmacht [Public Domain] In zijn vloeibare vorm (bovenste beeld) is het lichtblauw en zijn kristallen ook blauwachtig; Maar ze kunnen roze, oranje en zelfs roodachtige tonen verwerven (zoals zal worden verklaard in het gedeelte van hun structuur).
Atoomgewicht
15.999 u.
Atoomnummer (z)
8.
Smeltpunt
-218.79 ºC.
Kookpunt
-182.962 ºC.
Dikte
In normale omstandigheden: 1,429 g/l. Zuurstof is een dichtste gas dan lucht. Bovendien is het een slechte geleider van warmte en elektriciteit. En op het kookpunt (vloeistof) is de dichtheid 1.141 g/ml.
Drievoudige punt
54,361 K en 0,1463 kPa (14,44 atm).
Kritisch punt
154.581 K en 5.043 MPA (49770.54 ATM).
Fusiewarmte
0,444 kJ/mol.
Verdampingswarmte
6.82 kJ/mol.
Molaire caloriecapaciteit
29,378 J/(mol · k).
Dampdruk
Bij een temperatuur van 90 K heeft een stoomdruk van 986,92 atm.
Oxidatietoestanden
-2, -1, +1, +2. De belangrijkste oxidatiestatus is -2 (of2-)).
Elektronegativiteit
3.44 op de Pauling -schaal
Ionisatieenergie
Eerst: 1.313.9 kJ/mol.
Ten tweede: 3.388.3 kJ/mol.
Derde: 5.300,5 kJ/mol.
Magnetische volgorde
Paramagnetisch.
Oplosbaarheid in water
Zuurstofoplosbaarheid in water neemt af naarmate de temperatuur toeneemt. Bijvoorbeeld: 14,6 ml zuurstof/L water wordt opgelost bij 0 ºC en 7,6 ml zuurstof/L water bij 20 ºC. De oplosbaarheid van zuurstof in drinkwater is groter dan bij zeewater.
In de temperatuurconditie 25 ºC en bij een druk 101,3 kPa kan het drinkwater 6,04 ml zuurstof/L water bevatten; Terwijl zeewaterwater slechts 4,95 ml zuurstof/L water.
Reactiviteit
Zuurstof is een zeer reactief gas dat direct reageert met bijna alle elementen bij kamertemperatuur en hoge temperaturen; Behalve metalen met hogere reductiepotentialen dan koper.
U kunt ook reageren met de verbindingen, oxideren van de elementen die erin aanwezig zijn. Dit is wat er gebeurt wanneer het reageert met glucose, bijvoorbeeld om water en koolstofdioxide te produceren; of wanneer het hout of een koolwaterstof brandt.
Zuurstof kan elektronen accepteren door volledige of gedeeltelijke overdracht, dus wordt het als een oxidatiemiddel beschouwd.
Het meest voorkomende oxidatienummer of oxidatiestatus is -2. Met dit oxidatienummer wordt het in het water gevonden (h2O), zwaveldioxide (dus2) en koolstofdioxide (CO2)).
Ook in organische verbindingen zoals aldehyden, alcoholen, carbonzuren; gewone zuren zoals h2SW4, H2CO3, Hno3; en in zijn afgeleide zouten: NA2SW4, NA2CO3 oke Nee3. In allemaal zou het bestaan van de O kunnen worden aangenomen2- (wat niet waar is voor organische verbindingen).
Oxiden
Zuurstof is aanwezig als of2- In de kristallijne structuren van metaaloxiden.
Aan de andere kant, in metalen superoxiden, zoals kaliumsuperoxide (KO2), zuurstof is als ion of2-. In metaalperoxiden, om bariumperoxide te zeggen (Bao2), zuurstof wordt gepresenteerd als het ion of22- (BA2+OF22-)).
Isotopen
Zuurstof heeft drie stabiele isotopen: 16Of, met 99,76% overvloed; Hij 17Of, met 0,04%; en de 18Of, met 0,20%. Merk op dat hij 16Of het is verreweg de meest stabiele en overvloedige isotoop.
Elektronische structuur en configuratie
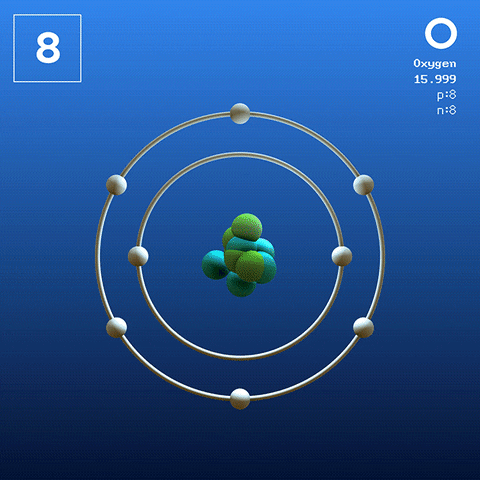
Zuurstofmolecuul en interacties
 Diatomeeënmolecuul. Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Diatomeeënmolecuul. Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Zuurstof in zijn basale toestand is een atoom waarvan de elektronische configuratie is:
[Hij] 2s2 2 p4
Volgens de Valencia Link Theory (TEV) zijn twee zuurstofatomen covalent gekoppeld, zodat beide hun octet van Valencia afzonderlijk voltooien; Naast het kunnen paren om hun twee eenzame elektronen van de orbitalen te paren 2p.
Op deze manier verschijnt het zuurstof diatomee molecuul, of2 (Hogere afbeelding), die een dubbele binding heeft (o = o). De energiestabiliteit is zodanig dat zuurstof nooit wordt gevonden als individuele atomen in de gasvormige fase, maar als moleculen.
Omdat de O2 Hij is homonucleair, lineair en symmetrisch, mist permanent dipoolmoment; Daarom zijn de intermoleculaire interacties afhankelijk van zijn moleculaire massa en de dispersiekrachten in Londen. Deze krachten zijn relatief zwak voor zuurstof, wat verklaart waarom het een gas is in terrestrische omstandigheden.
Wanneer de temperatuur echter daalt of de druk verhoogt, moleculen of2 Ze worden gedwongen samenhangend te zijn; tot het punt dat hun interacties aanzienlijk worden en de vorming van vloeistof of vaste zuurstof mogelijk maken. Om te proberen ze moleculair te begrijpen, is het noodzakelijk om de O niet uit het oog te verliezen2 Als structurele eenheid.
Ozon
Zuurstof kan andere aanzienlijk stabiele moleculaire structuren aannemen; Dat wil zeggen, het wordt in de natuur (of binnen het laboratorium) gevonden in verschillende allotrope vormen. De ozon (lagere afbeelding), of3, Het is bijvoorbeeld de tweede alotroop van de bekendste zuurstof.
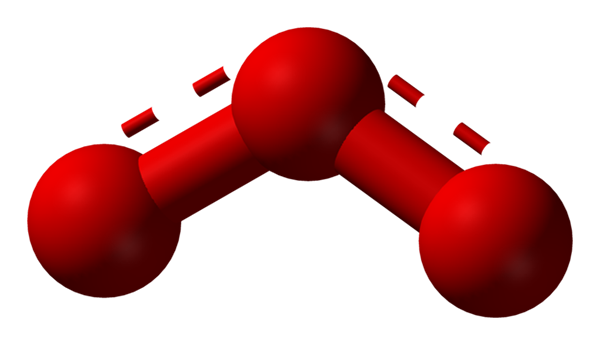 Structuur van de resonantiehybride weergegeven door een model van bollen en staven voor de ozonmolecuul. Bron: Ben Mills via Wikipedia.
Structuur van de resonantiehybride weergegeven door een model van bollen en staven voor de ozonmolecuul. Bron: Ben Mills via Wikipedia. Nogmaals, de TEV houdt vast, legt uit en toont dat in de OK3 Er moeten resonantiestructuren zijn die de positieve formele belasting van de middelste zuurstof stabiliseren (lijnen in het rood gestippeld); Terwijl zuurstof vanaf het einde van de boemerang een negatieve belasting wordt verdeeld, waardoor de totale belasting voor ozon wordt veroorzaakt.
Kan u van dienst zijn: Oplosbaarheidsregels: algemene aspecten en regelsOp deze manier zijn de links niet eenvoudig, maar niet dubbel. Voorbeelden van resonantiehybriden komen veel voor in zoveel moleculen of anorganische ionen.
De O2 I3, Als gevolg hiervan zijn hun moleculaire structuren verschillend, geldt hetzelfde voor hun fysische en chemische eigenschappen, vloeistof- of kristalfasen (zelfs als beide zuurstofatomen consumeren). Ze theoretiseren die synthese op grote schalen van cyclische ozon is waarschijnlijk, waarvan de structuur lijkt op die van een roodachtige en geoxygeneerde driehoek.
Tot nu toe komen de "normale alotropen" van zuurstof aan. Er zijn echter twee anderen om te overwegen: O4 I8, respectievelijk gevonden of voorgesteld in vloeistof en vaste zuurstof.
Vloeibare zuurstof
Gasvormige zuurstof is kleurloos, maar wanneer de temperatuur daalt tot -183 ºC, condenseert in een lichtblauwe vloeistof (celestial vergelijkbaar). Interacties tussen moleculen of2 Het is nu dat zelfs hun elektronen fotonen in het rode gebied van het zichtbare spectrum kunnen absorberen om de karakteristieke blauwe kleur weer te geven.
Het is echter theoretiseerd dat er in deze vloeistof meer dan eenvoudige moleculen zijn of2, maar ook een molecuul of4 (lagere afbeelding). Het lijkt erop dat de ozon een ander zuurstofatoom had "vastgehouden" dat op de een of andere manier door de nieuw beschreven formele formele belasting tussenbeide kwam.
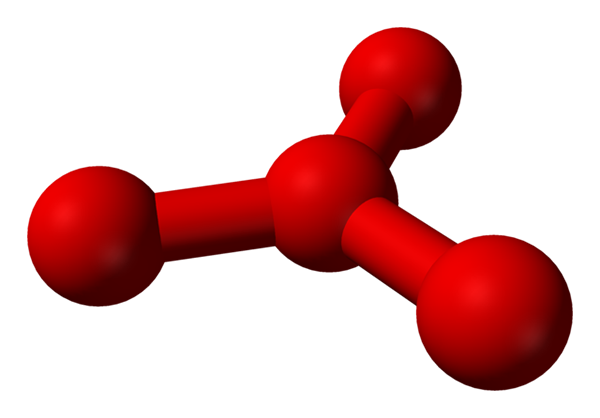 Model voorgestelde structuur met bollen en staven voor het tetraoxygen -molecuul. Bron: Benjah-bmm27 [Public Domain]
Model voorgestelde structuur met bollen en staven voor het tetraoxygen -molecuul. Bron: Benjah-bmm27 [Public Domain] Het probleem is dat volgens computer- en moleculaire simulaties, genoemde structuur voor de O4 Het is niet precies stabiel; Ze voorspellen echter dat ze bestaan als eenheden (of2))2, dat wil zeggen twee moleculen van O2 Ze naderen zoveel dat ze een soort onregelmatig frame vormen (atomen of zijn niet op elkaar afgestemd).
Vaste zuurstof
Zodra de temperatuur daalt naar -218,79 ºC, kristalliseert zuurstof in een eenvoudige kubieke structuur (γ -fase). Naarmate de temperatuur nog meer daalt, lijdt het kubieke glas overgangen naar de β -fasen (rhomboédica en bij -229,35 ºC) en α (monoklinisch en op -249,35 ºC).
Al deze kristallijne fasen van vaste zuurstof komen voor bij omgevingstruk (1 atm). Wanneer de druk toeneemt tot 9 GPa (~ 9000 atm), verschijnt de A -fase, waarvan de kristallen oranje zijn. Als de druk blijft toenemen tot 10 GPa, verschijnt de rode vaste zuurstof of fase ε (opnieuw monoklinisch).
Fase ε is speciaal omdat de druk zo groot is dat moleculen of2 Ze zijn niet alleen ondergebracht als eenheden of4, maar ook of8:
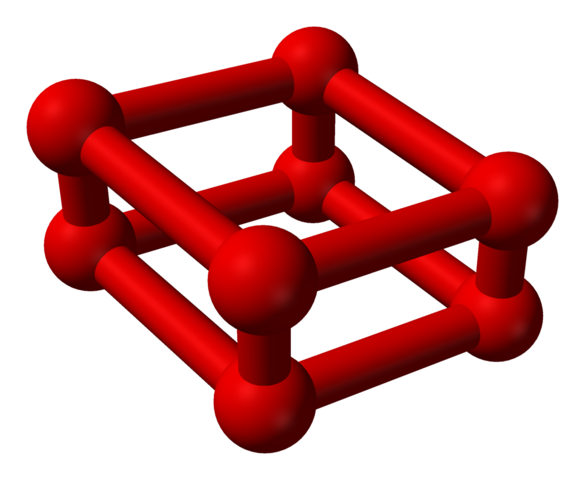 Modelstructuur met bollen en staven voor octaoxygen molecuul. Bron: Benjah-bmm27 [Public Domain]
Modelstructuur met bollen en staven voor octaoxygen molecuul. Bron: Benjah-bmm27 [Public Domain] Merk op dat dit of8 Het bestaat uit twee eenheden of4 waar het onregelmatige raamwerk al uitlegde. Het is ook geldig om het als vier of te beschouwen2 Nauw uitgelijnd en in verticale posities. De stabiliteit ervan is echter zodanig onder deze druk dat de OK4 I8 Het zijn twee extra alotropen voor zuurstof.
En ten slotte hebben we de fase ζ, metallic (tot druk groter dan 96 GPa), waarbij de druk elektronen in het glas maakt; Zoals bij metalen.
Waar is en productie
Mineralen
Zuurstof is in massa het derde element van het universum, achter waterstof en helium. Het vormt het meest voorkomende element van de korst van de aarde, die ongeveer 50% van zijn massa vertegenwoordigt. Het wordt voornamelijk gecombineerd met silicium, in de vorm van siliciumoxide (SIO2)).
Zuurstof maakt deel uit van ontelbaar mineraal. Evenzo bevindt het zich als onderdeel van talloze verbindingen zoals carbonaten, fosfaten, sulfaten, nitraten, enz.
Lucht
Zuurstof vormt 20,8% atmosferische lucht in volume. In de troposfeer is het voornamelijk als een diatomic zuurstofmolecuul. Terwijl in de stratosfeer een gasvormige laag tussen 15 en 50 km van het aardoppervlak is, is als ozon.
Ozon wordt geproduceerd door een elektrische schok op het molecuul van O2. Deze alotroop van zuurstof absorbeert het ultraviolette licht van zonnestraling, waardoor de schadelijke werking bij mensen wordt geblokkeerd, die in extreme gevallen wordt geassocieerd met het uiterlijk van melanomen.
Vers en zout water
Zuurstof is een hoofdcomponent van zeewater en zoet water van meren, rivieren en grondwater. Zuurstof maakt deel uit van de chemische waterformule, en masseert 89% ervan.
Aan de andere kant, hoewel de oplosbaarheid van zuurstof in het water relatief laag is, is de hoeveelheid zuurstof die hierin is opgelost, essentieel voor het waterleven, waaronder talloze soorten dieren en algen.
Levende wezens
De mens wordt gevormd, ongeveer 60% van het water en tegelijkertijd rijk aan zuurstof. Maar bovendien maakt zuurstof deel uit van tal van verbindingen, zoals fosfaten, carbonaten, carbonzuren, ketonen, enz., die essentieel zijn voor het leven.
Zuurstof is ook aanwezig in polysachariden, lipiden, eiwitten en nucleïnezuren; dat wil zeggen, de zo -aangeduurde biologische macromoleculen.
Het maakt ook deel uit van het schadelijke verspilling van de activiteit van de mens, bijvoorbeeld: koolstofdioxide en dioxide, evenals zwaveldioxide.
Biologische productie
 Planten zijn verantwoordelijk voor het verrijken van zuurstoflucht in ruil voor koolstofdioxide die we uitademen. Bron: Pexels.
Planten zijn verantwoordelijk voor het verrijken van zuurstoflucht in ruil voor koolstofdioxide die we uitademen. Bron: Pexels. Zuurstof treedt op tijdens fotosynthese, een proces waarmee mariene fytoplankton en terrestrische planten lichte energie gebruiken om koolstofdioxide met water te reageren, waardoor glucose wordt veroorzaakt en zuurstof vrijgeeft.
Naar schatting is meer dan 55% van de door fotosynthese geproduceerde zuurstof te wijten aan de werking van het mariene fytoplankton. Daarom vormt het de belangrijkste bron van zuurstofgeneratie op aarde en is het verantwoordelijk voor het onderhoud van het leven erin.
Industriële productie
Luchtvloeibaarheid
De belangrijkste industriële zuurstofproductiemethode wordt opgericht in 1895, onafhankelijk van Karl Paul Gottfried von Linde en William Hamson. Deze methode gebruikt momenteel enkele wijzigingen.
Kan u van dienst zijn: butanone: structuur, eigenschappen en gebruikHet proces begint met luchtcompressie om waterdamp te condenseren en zo te elimineren. Vervolgens wordt de lucht gezeefd wanneer het wordt uitgevoerd door een mengsel van zeoliet en silicagel, voor de eliminatie van koolstofdioxide, zware koolwaterstoffen en de rest van het water.
Vervolgens worden de componenten van vloeibare lucht gescheiden door een fractionele destillatie, waardoor de scheiding van de aanwezige gassen in zijn verschillende kookpunten wordt bereikt. Volgens deze methode wordt zuurstof verkregen met 99% zuiverheid.
Waterelektrolyse
Zuurstof wordt geproduceerd door sterk gezuiverde waterelektrolyse en met elektrische geleidbaarheid die niet groter is dan 1 µs/cm. Water wordt gescheiden door elektrolyse in zijn componenten. Waterstof als kation beweegt naar de kathode (-); Terwijl zuurstof naar de anode beweegt (+).
De elektroden hebben een speciale structuur om de gassen te verzamelen en vervolgens hun vloeibaar te maken.
Thermische ontleding
De thermische ontleding van verbindingen zoals kwikoxide en gastheer (kaliumnitraat), geeft zuurstof af, die kan worden verzameld voor gebruik. Peroxiden worden ook voor dit doel gebruikt.
Biologisch papier
Zuurstof wordt geproduceerd door fytoplankton en landplanten via fotosynthese. Het kruist de longwand en in het bloed wordt het vastgelegd door hemoglobine, die het naar verschillende organen transporteert en vervolgens wordt gebruikt in celmetabolisme.
In dit proces wordt zuurstof gebruikt tijdens het metabolisme van koolhydraten, vetzuren en aminozuren, om uiteindelijk koolstofdioxide en energie te produceren.
Ademhaling kan als volgt scheppen:
C6H12OF6 + OF2 => CO2 + H2Of +energie
Glucose wordt gemetaboliseerd in een reeks sequentiële chemische processen, waaronder glycolyse, de Krebs -cyclus, de elektronische transportketen en oxidatieve fosforylering. Deze reeks gebeurtenissen produceert energie die zich ophoopt als ATP (Adenosín Triposfaat).
De ATP wordt gebruikt in verschillende processen in cellen die het transport van ionen en andere stoffen door het plasmamembraan omvatten; de darmabsorptie van stoffen; de samentrekking van verschillende spiercellen; Het metabolisme van verschillende moleculen, enz.
Polymorfonucleaire en macrofaag leukocyten zijn fagocytische cellen die in staat zijn om zuurstof te gebruiken om superoxide -ionen, waterstofperoxide en enkele zuurstof te produceren, die worden gebruikt om micro -organismen te vernietigen.
Risico's
Het inademen van zuurstof in hoge druk kan misselijkheid, duizeligheid, spierspasmen, verlies van gezichtsvermogen, epileptische aanvallen en bewustzijnsverlies veroorzaken. Bovendien veroorzaakt het inademen van zuivere zuurstof gedurende een lange periode longirritatie, gemanifesteerd door hoest en een verkorting van ademhaling.
Het kan ook de oorzaak zijn van de vorming van een longoedeem: een zeer ernstige aandoening die de ademhalingsfunctie beperkt.
Een atmosfeer met een hoge zuurstofconcentratie kan gevaarlijk zijn, omdat het de ontwikkeling van branden en explosies vergemakkelijkt.
Toepassingen
Artsen
Zuurstof wordt toegediend aan patiënten met ademhalingsfalen; Dat is het geval van patiënten die getroffen zijn door longontsteking, longoedeem of emfyseem. Ze konden geen zuurstof in het milieu ademen omdat ze ernstig zouden worden getroffen.
Patiënten met hartfalen in wat wordt gepresenteerd vloeibare accumulatie in alveoli moet ook zuurstof nodig hebben om te worden geleverd; Zoals patiënten die een ernstig vasculair ongeval hebben gehad (beroerte).
Beroepsbehoefte
Brandweerlieden die een brand bestrijden in een omgeving met ongepaste ventilatie, vereisen het gebruik van maskers en zuurstoffles waarmee ze hun functies kunnen vervullen, zonder hun leven in grotere risico te brengen.
Onderzeeërs zijn uitgerust met zuurstofproductieapparatuur waarmee zeilers in een gesloten omgeving kunnen blijven zonder atmosferische luchttoegang.
De duikers doen hun werk ondergedompeld in het water en daarom geïsoleerd uit atmosferische lucht. Ze ademen door zuurstof gepompt door buizen verbonden met hun scan of het gebruik van bombones bevestigd aan het lichaam van de onderzeeër.
Astronauten voeren hun activiteiten uit in omgevingen die zijn uitgerust met zuurstofgeneratoren die overleven mogelijk maken tijdens ruimtereizen en in een ruimtestation.
Industrieel
Meer dan 50% van de industrieel geproduceerde zuurstof wordt verbruikt bij de transformatie van ijzer in staal. Het gietijzer wordt geïnjecteerd met een zuurstofstraal om de aanwezige zwavel en koolstof te elimineren; reageren om zo gassen te produceren2 en co2, respectievelijk.
Acetyleen wordt gebruikt in combinatie met zuurstof om metalen platen te snijden en ook om het lassen te produceren. Zuurstof wordt ook gebruikt bij de productie van glas, waardoor de verbranding in zijn bakken wordt verhoogd om de transparantie te verbeteren.
Atoomabsorptiespectrofotometrie
De combinatie van acetyleen en zuurstof wordt gebruikt om monsters van verschillende oorsprong te verbranden in een atoomabsorptiespectrofotometer.
Tijdens de procedure wordt een lichtstraal van een lamp beïnvloed door de vlam, die specifiek is voor het element dat gewenst is om te kwantificeren. De vlam absorbeert het licht van de lamp, waardoor het element de kwantificering van het element mogelijk maakt.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Zuurstof. Opgehaald uit: in.Wikipedia.borg
- Richard Van Nordden. (13 september 2006). Gewoon een mooie fase? Vaste rode zuurstof: nutteloos maar verrukkelijk. Hersteld van: natuur.com
- Azonano. (4 december 2006). Vaste zuurstof e-fase kristalstructuur bepaald langs de ontdekkingen van een zuurstof O8-cluster. Hersteld van: Azonano.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Zuurstofmolecuul. PubChem -database. CID = 977. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2019). Feiten van zuurstofelement. Chemicool. Hersteld van: chemicool.com
- Robert C. Gek. (9 juli 2019). Zuurstof: chemisch element. Encyclopædia Britannica. Hersteld van: Britannica.com
- Wiki -kinderen. (2019). Zuurstoffamilie: eigenschappen van via elementen. Hersteld van: eenvoudigweg.Wetenschap
- Advameg, Inc. (2019). Zuurstof. Hersteld van: madeHow.com
- Lentech B.V. (2019). Tabel van de periode: zuurstof. Hersteld van: Lentech.com
- New Jersey Department of Health and Senior Services. (2007). Zuurstof: factheis Hazardoous Substance. [PDF]. Hersteld van: nj.Gov
- Yamel Mattarollo. (26 augustus 2015). Industriële zuurstof industriële toepassingen. Hersteld van: Altecdust.com
- « Neon geschiedenis, eigenschappen, structuur, risico's, gebruik
- Histidine -kenmerken, structuur, functies, voedsel »

