Histidine -kenmerken, structuur, functies, voedsel
- 2918
- 389
- Dr. Rickey Hudson
De Histidine (Zijn, h) Het is een aminozuur dat wordt gebruikt voor eiwitsynthese. Het is een hydrofiel molecuul, dus het is in het algemeen georiënteerd op de buitenkant van eiwitstructuren wanneer ze in een vloeibaar medium zijn.
Het wordt beschouwd als een essentieel aminozuur voor het kweken van kinderen, omdat ze het niet produceren. Bij de volwassene is er een kleine histidineproductie, maar het is onvoldoende om te voldoen aan de dagelijkse vereisten, zodat het wordt beschouwd als een semi -essentieel aminozuur.
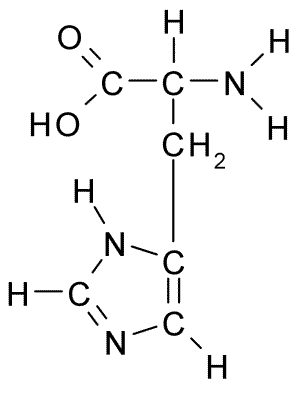
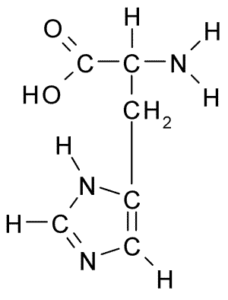 Chemische structuur van het histidine -aminozuur (Bron: Borb, via Wikimedia Commons)
Chemische structuur van het histidine -aminozuur (Bron: Borb, via Wikimedia Commons) Voor dieren en de mens is histidine een essentieel of op zijn minst semi -essentieel aminozuur, maar planten, schimmels en micro -organismen produceren efficiënt de histidine die ze nodig hebben en maken deel uit van de voedingsbronnen van histidine, naast eiwitten dieren.
Histidine vervult zeer belangrijke fysiologische functies in de mens zoals: die van het deel uitmaken van de actieve centra van vele enzymen, die deelnemen aan groei, in het immuunsysteem en bij de vorming van myeline in zenuwvezels, onder andere.
Histidine -biosynthese is een complex proces dat voornamelijk in de lever plaatsvindt en 9 tot 11 enzymatische stappen vereist. De afbraak ervan vindt plaats in de lever en de huid en gaat door de vorming van glutamaat en volgt vervolgens verschillende paden.
Veel voedingsmiddelen zijn rijk aan histidine, zoals dierlijke eiwitten zoals vlees en zuivelproducten, evenals planteneiwitten. Deze bieden veel van de dagelijkse histidinevereisten die ons lichaam nodig heeft om goed te werken.
Het tekort of overtollige histidine veroorzaakt door het erven van metabole of transportproblemen, of voedingsfalen bij inname, zijn gerelateerd aan enkele belangrijke problemen die de gezondheid beïnvloeden, zowel bij kinderen als bij volwassenen. Met voldoende histidineconsumptie kunt u in de meeste gevallen een gezond en gezond leven behouden.
[TOC]
Kenmerken
Een benadrukkende kenmerk van histidine is dat het kan worden omgezet in histamine, een stof die actief deelneemt aan vele allergische en inflammatoire reacties.
In de vissen die zijn blootgesteld aan de omgeving zonder voldoende koeling, kunnen bacteriën histidine omzetten in histamine en daarom veroorzaken ze, wanneer ze worden ingenomen, voedselvergiftiging.
Een ander kenmerk van dit aminozuur is dat het een van de weinigen is, onder de bestaande 22, die in het bereik van fysiologische pH (ongeveer 7.4) Het is geïoniseerd en kan daarom actief deelnemen aan de katalytische plaats van veel enzymen.
In het hemoglobinemolecuul is proximale histidine een van de hemo -groepsliganden. Met andere woorden, dit aminozuur neemt deel aan de zuurstoftransportfunctie van hemoglobine en is onmisbaar voor de synthese van dit eiwit, evenals voor myoglobine, dat ook bekend staat als "spierhemoglobine".
Structuur
Histidine is een aminozuur Hydrofiel polair essentieel, geclassificeerd in essentiële aminozuren, omdat het niet door dieren kan worden gesynthetiseerd. En zoals eerder vermeld, wordt het echter gesynthetiseerd door bacteriën, schimmels en planten.
Bij groeiende kinderen is histidine absoluut noodzakelijk; De volwassene kan het synthetiseren, maar het is niet duidelijk of dit de dagelijkse behoeften van histidine omvat, dus het moet worden ingenomen met het dieet.
Zoals alle aminozuren heeft histidine een α -koolstof waaraan een aminogroep, een carboxylgroep, een waterstofatoom en een zijketen is verbonden.
Kan u van dienst zijn: Coxiella BurnetiiDe laterale keten van dit aminozuur wordt gevormd door een imidazolring die, tot fysiologische pH, protonen en een positieve belasting verwerft en wordt genoemd "Imidazolio " afgekort als IMH+.
Samen met lysine en arginine vormt histidine de groep basisaminozuren. Van de drie is histidine de minst eenvoudig en de Imididoólica -ring kan onbeschermd zijn tot pH bijna 6.
Aangezien fysiologische pH -histidine protonen kan uitwisselen, neemt dit meestal deel aan enzymatische katalyse die de overdracht van protonen inhoudt. Omdat het een polair aminozuur is, wordt het meestal aangetroffen op het buitenoppervlak van de eiwitten, waar het in een waterig medium kan hydrateren.
Functie
Als onderdeel van de actieve enzymlocatie
Histidine is noodzakelijk voor de synthese van veel eiwitten, vooral enzymen waarvan de actieve centra dit aminozuur hebben. Het maakt deel uit van het actieve centrum van de aldlasasen van zoogdieren, waar het werkt als een protondonor.
Het bevindt zich in het actieve centrum van carboxipeptidase A, een pancreasenzym met een actieve plaats gevormd door Zn en histidine. In het glycolithische enzym mutasa fosfoglyceraat zijn er twee histidine -afval in zijn actieve centrum dat fungeert als acceptoren of donoren van fosforylgroepen.
Het wordt ook aangetroffen op de actieve plaats van enzymen zoals glyceraldehyde 3-fosfaatdehydrogenase, lactaatdehydrogenase, papain, chimotripsine, rNASA A en ammoniak liasa histidine (histidase) (histidase) (histidase) (histidase) (histidase) (histidase). Bovendien is het een remmer van het enzym glutamine synthetase.
Andere functies
Dit aminozuur is van groot belang voor het organisme, omdat het decarboxylase histidine decarn.
Histidine wordt geproduceerd door neuronen van het centrale zenuwstelsel met neuromodulerende functies.
Het is noodzakelijk voor de vorming van myelinepeulen van zenuwvezels, dus het speelt een belangrijke rol bij de overdracht van elektrische impulsen daarin.
Samen met groeihormoon en andere aminozuren draagt histidine bij aan weefselherstelmechanismen, voornamelijk in het cardiovasculaire systeem.
Sommige extra functies zijn:
- Draagt bij met de ontgifting van sommige zware metalen, omdat het werkt als chelaten.
- Beschermt tegen schade veroorzaakt door straling.
- Deelnemen aan de vorming van rode en witte bloedcellen.
- Het is noodzakelijk voor hemoglobinevorming.
- Het helpt bij het bestrijden van enkele negatieve effecten van reumatoïde artritis, zoals ontsteking en gebrek aan mobiliteit.
- Het is een belangrijk aminozuur voor capillaire regeneratie, groei en seksuele functie.
Carnosine, Anserine en homocosine, zijn Dipéptides gevormd uit histidine. De eerste twee zijn te vinden in de spieren en hebben belangrijke functies zoals tamponers en als activatoren van myosine atasa.
Homocosine wordt in de hersenen geproduceerd in hoeveelheden 100 keer hoger dan skeletspiervlees.
Biosynthese
Histidine verkrijgt het koolzuurhoudende skelet van de 5-fosfaatribose. In de bacterie EN. Coli, Dit aminozuur treedt op uit genoemde verbinding door middel van 11 enzymatische stappen:
- De eerste stap van de synthese bestaat uit de overdracht van een fosforibosyl van ATP naar koolstof 1 van de 5-fosfaatribose, waardoor 5-fosforibosyl-1-pyrofosfaat (PRPP) (PRPP) (PRPP) wordt gegenereerd (PRPP). De fosforibosyl-pyrofosfaatsynthetase (PRPP-synthetase) enzym katalyseert deze reactie.
- Vervolgens vindt de overdracht van de koolstofpyrofosfaatgroep 1 naar de N-1 van de ATP plaats en vindt de N1- plaats (5'-fosforibosyl) -atp. Het enzym dat deze reactie katalyseert, is de ATP fosforuseltransferase.
- Door de werking van fosforibosyl-top-pyrofosfaathydroxylase is de a, β-pyofosfaatverbinding van de ATP hydroxilase en wordt de N1- gevormd (5'-fosforibosyl) -amp.
- Het fosforibosyl-MAP enzymhydroxylase opent de puriniering tussen de N-1 en de C-6 en het ribonucleotide wordt gevormd N1- (5'-fosforibosil Formimino) -5-aminoimidazol-4-carboxamide-1-lribonucleotide.
- Vervolgens wordt de ribofuranosa-ring die afkomstig is van de PRPP geopend en wordt hij geïmomeriseerd tot een ketosa, die de N1- (5'-fosforibosyl Formimine) -5-aminoimidazol-4-carboxamide-1-lribonucleotide vormt door effect van een isomerase-enzymen vormt.
- Het aminotransferase-enzym draagt de amide groep glutamine over, die glutamaat wordt, en verbreekt de formiminekop, zodat het 5-aminoimidazol-carboxamide-1-lribonucleotide en het imidazol-glycerolfosfaat wordt gegenereerd, wordt gegenereerd.
- Een watermolecuul van het imidazol-glycerolfosfaat wordt geëlimineerd door middel van het imidazol-glycerol fosfaatdehydratase en vormt imidazol-acetol fosfaat.
- Het imidazol-acetolfosfaat wordt overgebracht als een aminogroep door histidinoltransaminase-fosfaat en het fosfaathistidinol wordt gevormd.
- De fosforische estergroep van histidinolfosfaat om histidinol te vormen, wordt gehydrolyseerd. Histidinol fosfaat fospatase katalyseert deze reactie.
- Later wordt histidinol geoxideerd door histidinol dehydrogenase en is histidinaal.
- Dezelfde histidinol dehydrogenase oxideert naar de histidinal en maakt het histidine.
Het eerste enzym van de biosynthetische route van histidine wordt geremd door het product van de route, dat wil zeggen dat de histidine deelneemt aan de alestrische remming van de ATP -fosforibosyltransferase, die het belangrijkste regulatie van de route vertegenwoordigt.
Degradatie
Histidine, proline, glutamaat, arginine en glutamine zijn aminozuren die wanneer ze uiteindelijk a-zotoglurate vormen. Vier van hen worden eerst glutamaat, dat als gevolg van transaminatie aanleiding geeft tot a-ketoglutoraat.
Histidine verliest door histidinase de α-amino-groep om urocanato te worden. Vervolgens hydrateert de Urocanase posities 1 en 4 van de Urocanato, die het 4-medazolon-5-propionaat vormt. Vervolgens vindt de imino-groep van de 4-medazolon-5-propionato plaats en vormt de n-formiminoglutamato.
De laatste reactie impliceert de overdracht van het formyl van het N-formimiminoglutamaat naar tetrahydrofolaat, dat werkt met het enzym glutamaat formimineuze overdracht. De eindproducten van deze reactie zijn glutamaat en N5-formimino tetrahydropholaat.
Α-ketoglutaraat wordt gevormd door glutamaattransaminatie. Α-ketoglutaraat is een intermediair van de Krebs-cyclus en kan ook de gluconeogene route binnenkomen voor glucosevorming.
De glutamato -aminogroep komt de ureumproductiecyclus in om te worden geëlimineerd door urine. Al deze reacties komen voor in de lever en een deel van hen op de huid.
Voedsel rijk aan histidine
De dagelijkse histidine -behoeften zijn ongeveer 10 tot 11 mg per kg lichaamsgewicht, per dag. Bij groeiende kinderen is histidine een essentieel aminozuur dat moet worden voorzien van het dieet.
Bij andere dieren is histidine ook een essentieel aminozuur en moeten die in stallen histidine ontvangen om hun normale hemoglobinespiegels te behouden.
Onder de voedingsmiddelen die rijk zijn aan histidine zijn:
- Rundvlees, lam, varkensvlees, kip en kalkoen. Het wordt ook gevonden in vissen zoals tonijn (zelfs in ingeblikte), zalm, forel, pargo en lubina, evenals in sommige zeevruchten.
Kan u van dienst zijn: bloedcultuur: waar is het voor, foundation, procedure, resultaten- Melk en zijn derivaten, vooral in gerijpte kazen zoals Parmezaanse kaas, Gruyere, Zwitserse kaas, Gouda, onder anderen. In de inboorlingen, in het serum, in de yoghurt en in de zure room.
- Sojabonen en noten zoals noten en zaden. In zonnebloem, pompoen, watermeloen, sesam, amandelen, pistache, pindakaas en chia.
- Eieren en bonen of witte bonen.
- Volle granen zoals quinoa, tarwe, integrale rijst, etc.
Voordelen van uw inname
Er zijn een aantal pathologische aandoeningen waarin histidine nuttig kan zijn als adjuvans voor behandeling.
Onder deze pathologieën kunnen we reumatoïde artritis noemen, arteriële hypertensie (omdat een hypotensief effect van histidine is beschreven), in infecties, frigiditeit en seks en gehoor, zweren en anemieën.
In de huid produceert de afbraak van verbruikte histidine urocanzuur, dat in staat is om de huid te beschermen, omdat deze ultraviolette stralen absorbeert.
Overtollig consumptie door gezonde personen produceert geen grote veranderingen, omdat het snel wordt afgebroken. Het gebruik van histidine -voedingssupplementen bij patiënten met ernstige lever- en/of nierproblemen moet echter worden beperkt.
Deficiëntiestoornissen
Het histidine -tekort is gerelateerd aan wijzigingen in de verschuldigde immuunrespons.
Botproblemen, doofheid en anemieën geassocieerd met histidinetekort zijn ook gemeld.
De ziekte van Hartnup is een erfelijke aandoening die het transport van histidine en tryptofaan beïnvloedt door het slijmvlies van de dunne darm en de nieren, die een tekort van beide aminozuren veroorzaakt.
De meest relevante klinische manifestaties zijn het uiterlijk van schegous en rode laesies in de huid na blootstelling aan de zon, verschillende graden van bewegingsverandering en sommige symptomen van psychiatrische ziekten.
Histidinemie is een autosomische recessieve ziekte die wordt gekenmerkt door het tekort van het histidase -enzym, dat een toename van de concentraties van histidine in bloed en urine veroorzaakt.
Als gevolg hiervan kunnen deze patiënten histidine niet afbreken tot urocaal zuur in de lever en de huid. Deze ziekte gaat gepaard met matige mentale retardatie, spraakafwijkingen en auditief geheugen zonder doofheid.
De beperking van de histidine -inname als behandeling is niet effectief geweest bij het genereren van klinische verbetering en houdt het risico in om groeisal te genereren bij kinderen die door deze ziekte zijn getroffen.
Referenties
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biochemie (3e ed.)). San Francisco, Californië: Pearson.
- Murray, r., Bender, D., Botham, k., Kennelly, p., Rodwell, V., & Weil, p. (2009). Harper's geïllustreerde biochemie (28e ed.)). McGraw-Hill Medical.
- Nelson, D. L., & Cox, m. M. (2009). Lehninger -principes van biochemie. Omega -edities (5e ed.)). doen.borg
- Perecarz, P., Farri, L., & Papageorgiou, een. (1983). De effecten van moedermelk en formules met lage eiwitten op de snelheden van totale lichaamseiwitverschuiving en urine 3-methylhistidine-uitscheiding van premature baby's. Klinische wetenschap, 64, 611-616.
- Lied, b. C., Joo, n., Aldini, g., & Yeum, k. (2014). Biologische functie van histidine-dipeptiden en metabool syndroom. Voedingsonderzoek en praktijk, 8(1), 3-10.
- « Zuurstofeigenschappen, structuur, risico's, gebruik
- Geschiedenis van de expertsystemen, kenmerken, voordelen, nadelen »

