Massalummer waar het uit bestaat en hoe het te krijgen (met voorbeelden)
- 4137
- 324
- Cecil Graham
Hij Massagetal o Massalummer van een atoom is de som van het aantal protonen en de hoeveelheid kernneutronen. Deze deeltjes worden door elkaar aangeduid met de naam van Nucleones, Daarom vertegenwoordigt het massanummer het bedrag van hen.
Laat n het aantal aanwezige neutronen en z het aantal protonen, als we bellen hoe het massanummer, dan:
A = n + z
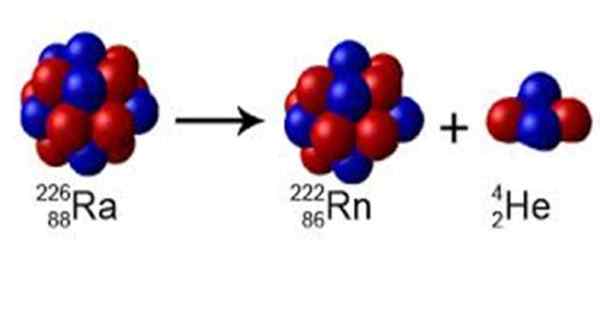
 Figuur 1. De radio heeft een massanummer A = 226, het vervalt om te radon met a = 222 en stoot een kern van helium van a = 4. Bron: Wikimedia Commons. Perox [CC0] [TOC]
Figuur 1. De radio heeft een massanummer A = 226, het vervalt om te radon met a = 222 en stoot een kern van helium van a = 4. Bron: Wikimedia Commons. Perox [CC0] [TOC]
Voorbeelden van massagummers
Onmiddellijk enkele voorbeelden van massagummers voor goed bekende elementen:
Waterstof
Het meest stabiele en overvloedige waterstofatoom is ook het eenvoudigste: 1 proton en een elektron. Omdat de waterstofkern geen neutronen heeft, is het waar dat a = z = 1.
Zuurstof
Een zuurstofkern heeft 8 neutronen en 8 protonen, daarom a = 16.
Koolstof
Life on Earth is gebaseerd op koolstofchemie, een lichtatoom met 6 protonen in zijn kern plus 6 neutronen, als a = 6 + 6 = 12.
Uranium
Dit zware element dan de vorige, staat bekend om zijn radioactieve eigenschappen. De uraniumkern heeft 92 protonen en 146 neutronen. Dan is uw massanummer a = 92 + 146 = 238.
Hoe u het massanummer kunt krijgen?
Zoals eerder gezegd, komt het massanummer A van een element altijd overeen met de som van het aantal protonen en het aantal neutronen dat zijn kern bevat. Het is ook een geheel getal, maar ... is er een regel in termen van de relatie tussen beide hoeveelheden?
Laten we eens kijken: alle hierboven genoemde elementen zijn licht, behalve uranium. Het waterstofatoom is, zoals we zeiden, het eenvoudigste. Het heeft geen neutronen, althans in de meest voorkomende versie, en in zuurstof en koolstof zijn er gelijk aantal protonen en neutronen.
Het kan je van dienst zijn: wat is de emissievezoek? (Met voorbeelden)Het gebeurt ook met andere lichtelementen, zoals stikstof, een ander zeer belangrijk gas voor het leven, dat 7 protonen en 7 neutronen heeft. Naarmate de kern echter complexer is en atomen zwaarder worden, neemt het aantal neutronen toe met een ander ritme.
In tegenstelling tot lichtelementen heeft uranium, met 92 protonen, ongeveer 1 ½ keer die hoeveelheid neutronen: 1 ½ x 92 = 1.5 x 92 = 138.
Zoals u kunt zien, is het vrij dicht bij 146, de hoeveelheid neutronen die het heeft.
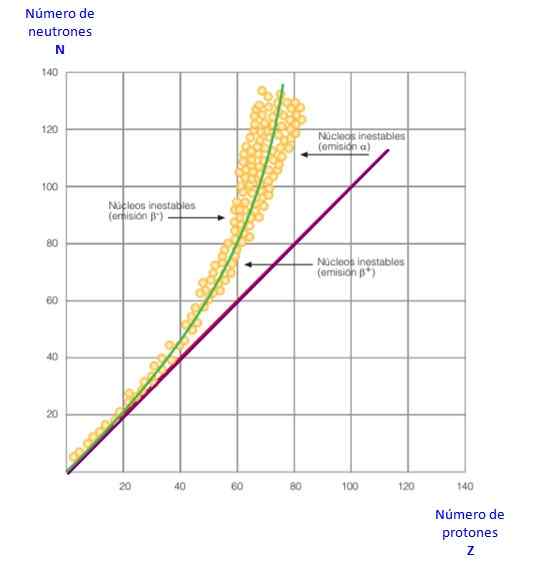 Figuur 2. Stabiliteitscurve. Bron: f. Zapata.
Figuur 2. Stabiliteitscurve. Bron: f. Zapata. Dit alles wordt duidelijk in de curve van figuur 2. Het is een grafiek van n versus z, bekend als nucleaire stabiliteitscurve. Daar is te zien hoe lichtatomen hetzelfde aantal protonen hebben als neutronen, en hoe van z = 20 het aantal neutronen toeneemt.
Op deze manier wordt het grote atoom stabieler, omdat overtollige neutronen de elektrostatische afstoting tussen protonen vermindert.
Notatie voor atomen
Een zeer nuttige notatie die snel het type atoom beschrijft, is als volgt: het symbool van het element en de respectieve atoom- en massa -getallen worden geschreven zoals hieronder weergegeven in dit schema:
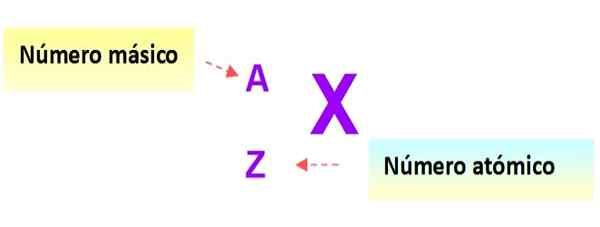 figuur 3. Atoomnotatie. Bron: f. Zapata.
figuur 3. Atoomnotatie. Bron: f. Zapata. In deze notatie zouden de atomen van de eerdere voorbeelden zijn:

Soms wordt een andere comfortabelere notatie gebruikt, waarin alleen het symbool van het element en het massacummer wordt gebruikt om het atoom aan te geven, waardoor het atoomnummer wordt weggelaten. Op deze manier, de 12 6C is eenvoudig geschreven als koolstof-12, de 16 8Of het zou oxygen-16 zijn en dus voor elk element.
Kan u van dienst zijn: halDe isotopen
Het aantal protonen in een kern bepaalt de aard van het element. Elk atoom waarvan de kern 29 protonen bevat, is bijvoorbeeld een koperatoom, wat er ook gebeurt.
Stel dat een koperatoom om welke reden dan ook een elektron verliest, maar toch is het nog steeds koper. Nu is het echter een geïoniseerd atoom.
Het is moeilijker voor een atoomkern om een proton te winnen of te verliezen, maar in de natuur kan het optreden. In de sterren zijn bijvoorbeeld continu gevormde zwaardere elementen van lichte elementen, omdat de sternucleus zich gedraagt als een fusiereactor.
En hier op aarde is er het fenomeen van de Radioactieve desintegratie, waarin sommige onstabiele atomen nucleonen verdrijven en energie uitzenden, transformerend in andere elementen.
Eindelijk is er de mogelijkheid dat een atoom van een bepaald element een ander massanummer heeft, in dit geval is het een isotoop.
Een goed voorbeeld is de bekende koolstof-14 of radiocarbon, die wordt gebruikt om archeologische objecten te dateren en als een biochemische tracer. Dit is dezelfde koolstof, met identieke chemische eigenschappen, maar met twee extra neutronen.
Carbon-14 is minder overvloedig dan koolstof-12, de stabiele isotoop, en is ook radioactief. Dit betekent dat het na verloop van tijd vervalt door energie en deeltjes uit te zenden totdat het een stabiel element wordt, wat in zijn geval stikstof is.
Koolstofisotopen
Koolstof bestaat in de natuur als een mengsel van verschillende isotopen, waarvan de meest voorkomende de eerder genoemde is 12 6C of koolstof-12. En naast koolstof-14 is de 13 6C met een extra neutron.
Kan u van dienst zijn: Wisselingsstroomcircuits: typen, toepassingen, voorbeeldenDit is gebruikelijk van aard, bijvoorbeeld van tin, 10 stabiele isotopen zijn bekend. Aan de andere kant staat een enkele isotoop bekend als het beryllium en natrium.
Elke isotoop, natuurlijk of kunstmatig, heeft een ander transformatieritme. Op dezelfde manier is het mogelijk om kunstmatige isotopen in het laboratorium te creëren, die meestal onstabiel zijn en radioactief vervallen binnen een zeer korte periode van tweede fracties, terwijl anderen veel meer nemen, zoveel meer als de leeftijd van de aarde of meer.
Natuurlijke koolstofisotooptabel
| Koolstofisotopen | Atoomnummer z | Massienummer a | Overvloed % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.elf |
| 14 6 C | 6 | 14 | Sporen |
Opgeloste voorbeelden
- voorbeeld 1
Wat is het verschil tussen 13 7 N en 14 7 N?
Antwoord
Beide zijn stikstofatomen, omdat hun atoomnummer 7 is. Een van de isotopen, die a = 13 heeft, heeft echter een minder neutron, terwijl de 14 7 N is de meest voorkomende isotoop.
- Voorbeeld 2
Hoeveel neutronen zijn er in de kern van een kwikatoom, aangeduid als 201 80 Hg?
Antwoord
Omdat a = 201 en z = 80, en ook weten dat:
A = z + n
N = a - z = 201 - 80 = 121
En er wordt geconcludeerd dat het kwikatoom 121 neutronen heeft.
Referenties
- Connor, n. Wat is nucleon - structuur van atomaire kern - definitie. Opgehaald uit: periodiek-rable.borg.
- Ridder, r. 2017. Fysica voor wetenschappers en engineering: een strategiebenadering. Pearson.
- Sears, Zemansky. 2016. Universitaire natuurkunde met moderne natuurkunde. 14e. ED. Deel 2.
- Tippens, p. 2011. Fysica: concepten en toepassingen. 7e editie. McGraw Hill.
- Wikipedia. Massagetal. Opgehaald uit: in.Wikipedia.borg.
- « Magnesiumnitraat (mg (No3) 2) structuur, eigenschappen, gebruik
- Coplanares Points -vergelijking, voorbeeld en opgeloste oefeningen »

