Magnesiumnitraat (mg (No3) 2) structuur, eigenschappen, gebruik

- 4624
- 738
- Pete Heaney V
Hij Magnesiumnitraat Het is een anorganische vaste stof waarvan de chemische formule mg is (nee3))2. Het is een ionische verbinding gevormd door de vereniging van een magnesiumkation2+ en twee nitraat anionen nee3-.
De Mg (nee3))2 Het is een kristallijne witte vaste stof. Het is erg hygroscopisch, dat wil zeggen, het absorbeert water gemakkelijk uit de omgeving. Door in contact te blijven met de lucht van de omgeving, heeft het de neiging zijn mg hexahydraat te vormen (nee3))2 •6h2OF.
 Mg magnesiumnitraat (nee3))2 poederd. Ondřej Mangl [Public Domain]. Bron: Wikimedia Commons.
Mg magnesiumnitraat (nee3))2 poederd. Ondřej Mangl [Public Domain]. Bron: Wikimedia Commons. Magnitraat hexahydraat (nee3))2 •6h2O Het heeft in zijn kristallijne structuur 6 watermoleculen h2Of voor elk Mg -molecuul (nee3))2. Magnesiumnitraat wordt aangetroffen in grotten en mijnen in de vorm van nitromagnesiet mineraal.
De Mg (nee3))2 Het wordt commercieel verkregen door het mg -metaalmetaal te reageren met salpeterzuur HNO3.
Het heeft zeer gevarieerd gebruik, zoals landbouw als meststof omdat het voedzame elementen biedt voor planten zoals stikstof (N) en magnesium (MG).
Het wordt gebruikt in de vuurwerkindustrie of pyrotechniek en ook bij het verkrijgen van geconcentreerd salpeterzuur. Het wordt gebruikt in chemische analyse, in fysica -experimenten en medische en wetenschappelijke studies.
[TOC]
Structuur
Anhydro magnesiumnitraat wordt gevormd door een magnesio mg kation2+ en twee nitraat anionen nee3-.
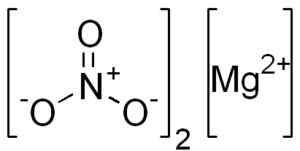 Mg structuur (nee3))2. Edgar181 [Public Domain]. Bron: Wikimedia Commons.
Mg structuur (nee3))2. Edgar181 [Public Domain]. Bron: Wikimedia Commons. Het magnesio mg ion2+ Het heeft een elektronische configuratie: 1s2, 2s2 2 p6, 3S0, Welnu, de twee elektronen van de buitenste laag (3s) hebben toegevoegd. Deze conformatie is erg stabiel.
Het ionen nr3- Het heeft een vlakke en symmetrische structuur.
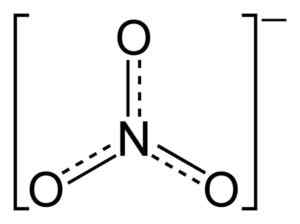 Platte nitraationstructuur nee3-. De stippellijnen geven de billijke verdeling van elektronen tussen de drie N-O-bindingen aan. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Platte nitraationstructuur nee3-. De stippellijnen geven de billijke verdeling van elektronen tussen de drie N-O-bindingen aan. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. In de structuur van NO3- De negatieve belasting wordt continu verdeeld tussen de drie zuurstofatomen.
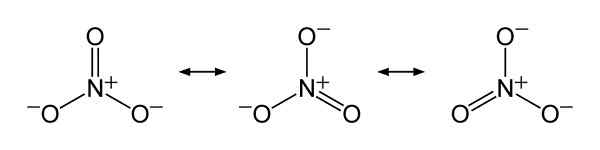 Nitraat ion resonantie structuren nee3-, Om de billijke verdeling van de negatieve belasting tussen de drie zuurstofatomen te verklaren. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Nitraat ion resonantie structuren nee3-, Om de billijke verdeling van de negatieve belasting tussen de drie zuurstofatomen te verklaren. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
-Anhydro magnesiumnitraat: mg (nee3))2
Kan u van dienst zijn: gedistilleerd water-Dihydrated magnesiumnitraat: mg (nee3))2 •2h2OF
-Hexahydraat magnesiumnitraat: mg (nee3))2 •6h2OF
-Magnesium -dinitraat
Eigenschappen
Fysieke staat
-Mg (nee3))2 Watervrij: witte vaste, kubieke kristallen.
-Mg (nee3))2 Dihydrado: kristallijne witte vaste stof.
-Mg (nee3))2 HexaHideed: kleurloze vaste, monokliene kristallen
Molecuulgewicht
-Mg (nee3))2 Watervrij: 148.31 g/mol
-Mg (nee3))2 Hexahydraat: 256.41 g/mol
Smeltpunt
-Mg (nee3))2 Hexahydraat: 88,9 ºC
Kookpunt
-Mg (nee3))2 Hexahydraat: niet koken, ontbinden bij 330 ° C
Dikte
-Mg (nee3))2 Watervrij: 2,32 g/cm3
-Mg (nee3))2 Dihydrared: 1,456 g/cm3
-Mg (nee3))2 Hexahydraat: 1,464 g/cm3
Oplosbaarheid
Anhydro magnesiumnitraat is zeer oplosbaar in water: 62,1 g/100 ml bij 0 ºC; 69,5 g/100 ml bij 20 ºC. Het is ook erg hygroscopisch, in contact met de lucht vormt snel hexahydraat.
De Mg (nee3))2 Dihydrado is ook erg oplosbaar in water en ethanol. Het is hygroscopisch.
De Mg (nee3))2 Hexahydraat is ook erg oplosbaar in water. Het is matig oplosbaar in ethanol. Het is de meest stabiele van de drie in contact met de lucht, dat wil zeggen van de drie is degene die water uit de omgeving het minst absorbeert.
Verwarmingseffect
Door een waterige oplossing van Mg in te dienen (nee3))2 Voor verdamping van water is het zout dat kristalliseert hexahydraat: mg (nee3))2 •6h2OF. Hexahydraat betekent dat in de vaste stof elk Mg -molecuul (nee3))2 Het is gekoppeld aan 6 watermoleculen.
Er is ook Mg dihydraat (nee3))2 •2h2Of, waarin de mg (nee3))2 vaste stof is bevestigd aan 2 watermoleculen.
Verwarming mg hexahydraat (nee3))2 •6h2Of het anhydra -zout wordt niet verkregen, omdat magnesiumnitraat een hoge affiniteit heeft voor water.
Om deze reden, door het boven zijn smeltpunt te verwarmen, een gemengd nitraatzout en magnesiumhydroxide mg (nee3))2 •4 mg (oh)2.
Dit gemengde zout, wanneer het 400 ºC bereikt, ontleedt zich met magnesiumoxide en losmaken stikstofoxidengassen.
Het kan u van dienst zijn: calciumhypochloriet (Ca (Clo) 2)Het verkrijgen van
Het kan worden bereid door te reageren op MGCO magnesiumcarbonaat3 Met salpeterzuur HNO3, Carbon Dioxide Co opgeven2:
Mgco3 + 2 hno3 → mg (nee3))2 + CO2↑ + H2OF
Het kan ook worden verkregen met mg (OH) magnesiumhydroxide2 en salpeterzuur:
Mg (oh)2 + 2 hno3 → mg (nee3))2 + 2 H2OF
Commercieel verkregen op verschillende manieren:
1- Reagerend magnesio mg met salpeterzuur HNO3.
2- Door reactie van mgo magnesiumoxide met salpeterzuur HNO3.
3- Mag (OH) magnesiumhydroxide samenvoegen2 en NH ammoniumnitraat4NEE3, Magnesiumnitraat vormen met NH ammoniak detachement3.
Locatie in de natuur
De Mg (nee3))2 Hexahydraat wordt van nature aangetroffen in mijnen en grotten of grotten in de vorm van nitromagnesiet mineraal.
Dit mineraal is aanwezig wanneer de guano in contact komt met rijke rotsen in magnesium. De guano is het materiaal dat het gevolg is van het uitwerpselen van zeevogels en afdichtingen in zeer droge omgevingen.
Toepassingen
De Mg (nee3))2 Hexahydraat wordt gebruikt in keramische, chemie- en landbouwindustrie.
Deze verbinding is een meststoffen omdat het stikstof (N) biedt, een van de drie basiselementen die planten vereist, en magnesium (mg) die ook een secundaire component is die ook belangrijk is voor deze.
Op deze manier wordt het gebruikt met andere ingrediënten in kassen en in de hydrocultuurcultuur. De laatste is om planten te laten groeien in een waterige oplossing met kunstmestzouten in plaats van grond.
 Hydrocultuurcultuur. U kunt de kanalen zien waardoor de waterige oplossing met meststoffenzouten zoals mg magnesiumnitraat circuleert (nee3))2. Auteur: Marsraw. Bron: Pixabay.
Hydrocultuurcultuur. U kunt de kanalen zien waardoor de waterige oplossing met meststoffenzouten zoals mg magnesiumnitraat circuleert (nee3))2. Auteur: Marsraw. Bron: Pixabay. Het wordt ook gebruikt als katalysator bij het verkrijgen van petrochemische verbindingen. Hiermee kunt u de viscositeit aanpassen in bepaalde processen. Anhydro magnesiumnitraat wordt gebruikt in pyrotechniek, dat wil zeggen voor vuurwerkproductie.
 Vuurwerk bevat mg magnesiumnitraat (nee3))2. Auteur: gratis goos. Bron: Pixabay.
Vuurwerk bevat mg magnesiumnitraat (nee3))2. Auteur: gratis goos. Bron: Pixabay. Anhydro magnesiumnitraat is een uitdrogingsmiddel. Het wordt bijvoorbeeld gebruikt om geconcentreerd salpeterzuur te verkrijgen, omdat het water elimineert en zure dampen concentreert tot 90-95% van HNO's3.
Kan u van dienst zijn: diagonale regel Geconcentreerd salpeterzuur. De originele uploader was fantastisch bij Italiaanse Wikipedia. [Gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Bron: Wikimedia Commons.
Geconcentreerd salpeterzuur. De originele uploader was fantastisch bij Italiaanse Wikipedia. [Gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Bron: Wikimedia Commons. Het wordt ook gebruikt om ammoniumnitraat te bedekken en de vorming van parels van dergelijk gecomprimeerd materiaal mogelijk te maken.
Het heeft nut in inktformulering, toner (zwart poeder dat wordt gebruikt in fotokopieerde systemen) en kleurproducten. Het dient als magnesiumstandaard in analytische chemie.
Magnesium en cerio mg nitraatzout (nee3))2 •Frons3))3 Het is interessant voor fysica -experimenten bij lage temperaturen, omdat het wordt gebruikt als een koelmiddel bij adiabatische sumagnetisatie -experimenten (zonder warmteoverdracht).
Dit magnesium- en cerio -zout is gebruikt om extreem lage temperaturen van de Kelvin -schaal vast te stellen (dicht bij absolute nul).
In recente studies
Verschillende onderzoekers hebben mg gebruikt (nee3))2 In samenstellingen met synthetische en natuurlijke polymeren om de geleidbaarheid in magnesio -batterijen te verhogen.
Het is ook onderzocht bij de bouw van supercaugades voor opslag met hoge energie.
In ziektestudies
Magnesiumnitraat is toegediend aan laboratoriumratten met arteriële hypertensie (hoge druk) en er werd vastgesteld dat de bloeddruk de effecten van de complicaties van deze ziekte effectief afneemt en verzacht of verzacht.
Het heeft ook beschermende effecten aangetoond tegen neurologische aandoeningen (stoornis in neuronen) en tegen de dood bij ratten tijdens cactonprocessen van de halsslagader.
Referenties
- Qian, m. et al. (2018). Extraïne poreuze paarlaags koolstofatomen met hoge capaciteit door pechini-verbranding van magnesiumnitraatgel. ACS Appl Mater Interfaces 2018, 10 (1): 381-388. NCBI hersteld.NLM.NIH.Gov.
- ManjuLadevi, r. et al. (2018). Een onderzoek naar blend polymeer -elektrolyt op basis van poly. Ionics (2018) 24: 3493. Link hersteld.Springer.com.
- Kiruthika, s. et al. (2019). Eco-vriendelijke biopolymeer elektrolyt, pectine met magnesiumnitraatzout, voor toepassing in electochemische apparaten. J Solid State Electochem (2019) 23: 2181. Link hersteld.Springer.com.
- Vilskerts r. et al. (2014). Magnesiumnitraat verzwakt de stijging van de bloeddruk bij SHR -ratten. Magnes Res 2014, 27 (1): 16-24. NCBI hersteld.NLM.NIH.Gov.
- Kuzenkov v.S. en Krushinskii a.L. (2014). Beschermend effect van magnesiumnitraat tegen neurologische aandoeningen veroorzaakt door cerebrale ischemie bij ratten. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI hersteld.NLM.NIH.Gov.
- Ropp, r.C. (2013). Groep 15 (N, P, AS, SB en BI) Alkalische aardverbindingen. Magnesiumnitraat. In encyclopedie van de alkalische aardverbindingen. Hersteld van Scientedirect.com.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Deel 1. Vierde druk. John Wiley & Sons.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Magnesiumnitraat. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- « Concept en kenmerken van het technisch systeem, elementen, voorbeelden
- Massalummer waar het uit bestaat en hoe het te krijgen (met voorbeelden) »

