Coördinatienummer wat is, berekening, voorbeelden

- 3182
- 216
- Aaron Okuneva
Hij Coördinatiegetal Het is de hoeveelheid atomen, ionen of moleculen die interageren met een centrum in ionen- en coördinatieverbindingen. Dit concept kan ook worden toegepast op de moleculen, rekening houdend met hoeveel atomen aan elkaar zijn gekoppeld in plaats van het aantal van hun links.
Dit aantal is belangrijk omdat het de geometrieën van de complexen, de dichtheden van hun materiële fasen en zelfs het stereochemische (ruimtelijke) karakter van hun reactiviteiten definieert. Om hun definitie te vereenvoudigen, worden ze überhaupt beschouwd als een buur.
 In een gebied van munten kunnen we waarderen wat wordt bedoeld met coördinatienummer
In een gebied van munten kunnen we waarderen wat wordt bedoeld met coördinatienummer Beschouw bijvoorbeeld de vloer bestaande uit munten van de bovenste beeld. Alle munten hebben dezelfde grootte, en als elk wordt waargenomen, wordt het omgeven door zes anderen; dat wil zeggen, ze hebben zes buren, en daarom het coördinatienummer (c.N.) Voor de munten is het 6. Ditzelfde idee strekt zich nu uit tot drie -dimensionale ruimte.
Als hun radio's ongelijk zijn, heeft niet alle hetzelfde coördinatienummer. Bijvoorbeeld: hoe groter de valuta, hoe meer buren, het zal kunnen communiceren met een groter aantal munten eromheen. Het tegenovergestelde gebeurt met kleine munten.
[TOC]
Coördinatienummerconcept
Vs ion radio's. Coördinatiegetal
Het coördinatienummer is het aantal dichtstbijzijnde buren en die in principe rechtstreeks interageren met een centrum, dat meestal een metaalion is. Dus hebben we de munten opzij gezet om in plaats daarvan bollen te overwegen.
Dit metalen ion mN+, waar N Het is gelijk aan zijn oxidatie- of Valencia -nummer, interageert met andere buren (ionisch of moleculair) genaamd liganden. Hoe hoger het N (+2, +3, etc.), kleiner zal m zijnN+ En bijgevolg zullen de liganden gedwongen worden om meer te benaderen om met M te communicerenN+.
Kan u van dienst zijn: Butyric Fat: verkrijgen, typen, samenstelling, gebruik, voordelenDe volgende afbeelding illustreert het bovenstaande:
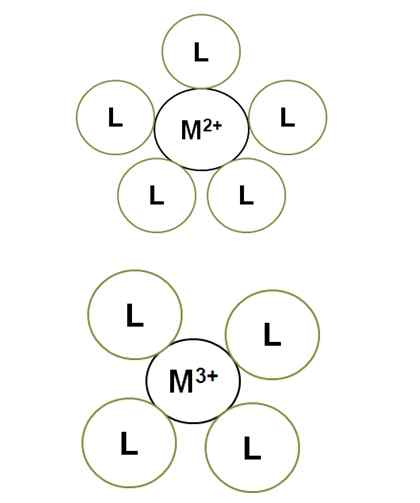 Variatie van het coördinatienummer met de centrale ionenbelasting. Bron: Gabriel Bolívar.
Variatie van het coördinatienummer met de centrale ionenbelasting. Bron: Gabriel Bolívar. M2+ In het verlichte complex heeft het een coördinatienummer van 5: het is omgeven door 5 liganden L. Ondertussen m3+ heeft een 4 coördinatienummer. Dit komt omdat m3+, Om een grotere omvang van belasting te hebben, contracteert de straal en daarom moeten de bindmiddelen meer naderen, wat hun elektronische afstotingen verhoogt.
Dat is de reden waarom omvangrijke centrale ionen, zoals die behoren tot blokmetalen F, of naar de tweede of derde periode van het blok D, Ze hebben de neiging om hogere coördinatienummers te hebben (c.N. > 6).
Dichtheden
Stel nu dat het M -complex3+ ondergaat druk. Een punt zal aankomen waar de druk zodanig zal zijn dat een andere link waarschijnlijk gecoördineerd is of met m interageert3+. Dat wil zeggen, het coördinatienummer zal toenemen van 4 tot 5.
Over het algemeen verhoogt de druk van de coördinatie, omdat buren elkaar dwingen op het centrale ion of atoom. Bijgevolg worden de materiaalfasen van deze stoffen dichter, compacter.
Geometrieën
Hogere illustraties zeggen niets over geometrieën rond M2+ of m3+. We weten echter dat een vierkant vier hoekpunten of hoeken heeft, net als een tetraëder.
Deze redenering wordt geconcludeerd dat geometrie rond M3+, Wiens c.N. Het is 4, het moet tetraëdrisch of vierkant zijn. Maar welke van de twee? Ondertussen, geometrieën voor m2+, Wiens c.N. Het is 5, ze kunnen een vierkante piramide of trigonale bipiramidaal zijn.
Elke c.N. Het heeft verschillende mogelijke geometrieën geassocieerd, die de bindmiddelen op een gunstige afstand positioneren, zodat er de minste afstoting tussen hen is.
Kan u van dienst zijn: interatomische linksHoe wordt het coördinatienummer berekend of bepaald?
Het coördinatienummer kan soms direct worden berekend. Stel dat het anionische complex [Ni (CN)5]3-. Wat is het coördinatienummer voor het nikkelion, of2+? Het is voldoende om de stoichiometrische coëfficiënt 5 te observeren, wat aangeeft dat er 5 cn anionen zijn- gecoördineerd of interactie met het centrum van Ni2+.
Het is echter niet altijd gemakkelijk. De CUCN -verbinding lijkt bijvoorbeeld een coördinatienummer van 1 te hebben beide voor Cu2+ Wat betreft de CN-. Het bestaat echter uit daadwerkelijk Cu-CN-Cu-CN-polymere ketens, dus het juiste coördinatienummer is 2.
Daarom heeft het coördinatienummer de voorkeur om het te bepalen in plaats van het te berekenen. Als? Het bepalen van de ionische of moleculaire structuren van de verbindingen. Dit is mogelijk dankzij instrumentale technieken zoals X -Ray -diffractie, neutronen of elektronen.
Voorbeelden van coördinatienummers
Volgende en uiteindelijk zullen enkele voorbeelden van verbindingen worden genoemd voor elk van de meest voorkomende coördinatienummers. Evenzo zal worden gezegd wat hun respectieve geometrieën zijn.
C.N. 2
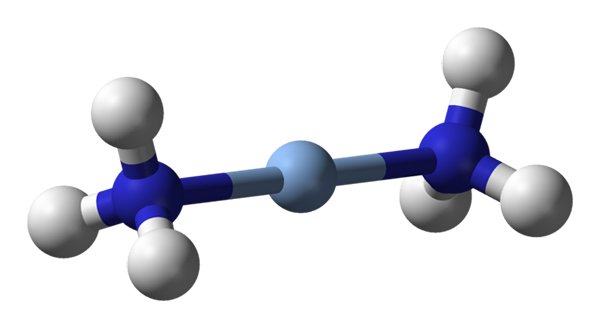 Hier wordt de lineaire geometrie van [Ag (NH3) 2] waargenomen+. Bron: Benjah-BMM27 / Public Domain
Hier wordt de lineaire geometrie van [Ag (NH3) 2] waargenomen+. Bron: Benjah-BMM27 / Public Domain A c.N. gelijk aan 2 betekent dat het centrale atoom of ion slechts twee buren heeft. Daarom praten we over verbindingen die verplicht zijn over lineaire geometrieën. Tussen hen hebben we:
-Hg (CH3))2
-[AG (NH3))2]+
-PH3Paucl
C.N. 3
 Elk koolstofatoom in dit grafietblad is verbonden met drie anderen, dus het heeft drie buren. Bron: Benjah-BMM27 / Public Domain
Elk koolstofatoom in dit grafietblad is verbonden met drie anderen, dus het heeft drie buren. Bron: Benjah-BMM27 / Public Domain A c.N. gelijk aan 3 betekent dat het centrale atoom of ion is omgeven door drie buren. We hebben dan geometrieën zoals: trigonaal (driehoekig) vlak, trigonale piramide en t vorm. Voorbeelden van verbindingen met dit coördinatienummer zijn:
Het kan u van dienst zijn: Atomic Mass: Definitie, Typen, hoe het te berekenen, voorbeelden-[Cu (CN)3]2-
-[Pt (Pcy3))3], Waar PCY verwijst naar het tricylohexylofospine -ligand
-Grafiet
C.N. 4
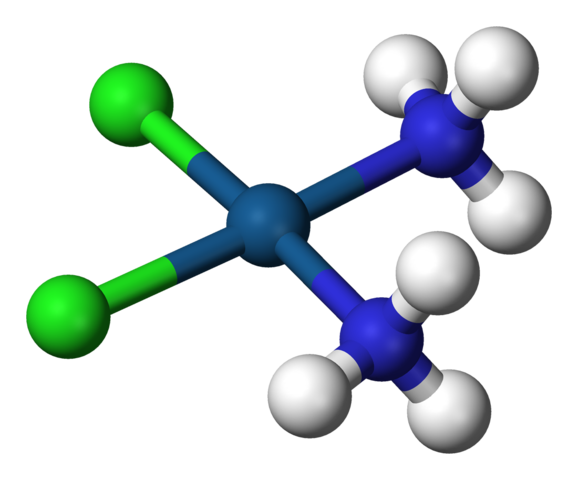 Vierkante geometrie van cisplatine, cis-PTCL2 (NH3) 2. Bron: Benjah-BMM27 / Public Domain
Vierkante geometrie van cisplatine, cis-PTCL2 (NH3) 2. Bron: Benjah-BMM27 / Public Domain A c.N. gelijk aan 4 betekent dat het centrale atoom of ion is omgeven door vier buren. De mogelijke geometrieën zijn tetraëdrisch of vierkant. Voorbeelden van verbindingen met dit coördinatienummer hebben het volgende:
-Ch4
-Cocl2pyr2
-Cis-ptcl2(NH3))2
-[Alcl4]-
-[Loeien4]2-
-SNCL4
-[Cro4]2-
-[MNO4]2-
Al deze voorbeelden, met uitzondering van de cis-ptcl2(NH3))2, Het zijn tetraëdrische geometrieën.
C.N. 5
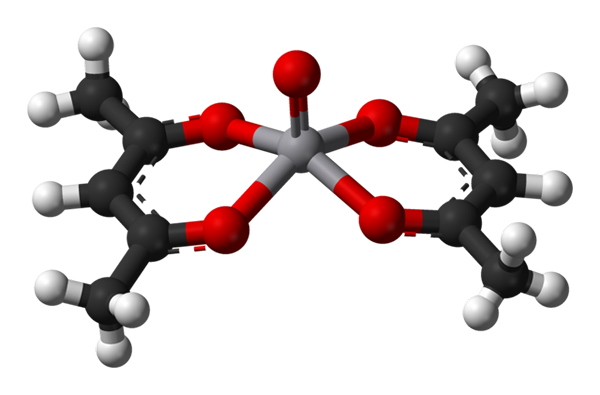 Vierkante piramide -geometrie voor VO (ACAC) 2. Bron: Benjah-BMM27 / Public Domain.
Vierkante piramide -geometrie voor VO (ACAC) 2. Bron: Benjah-BMM27 / Public Domain. A c.N. gelijk aan 5 betekent dat het atoom of het centrale ion wordt gecoördineerd of interactie aangaat met vijf buren. De al genoemde geometrieën zijn de vierkante piramide of trigonale bipiramidaal. Als voorbeelden hebben we het volgende:
-[Cobrn (ch2Ch2NME2))3]
-[FE (CO)5]
-Vo (ACAC)2, ACAC is het acetylacetonaatligand
C.N. 6
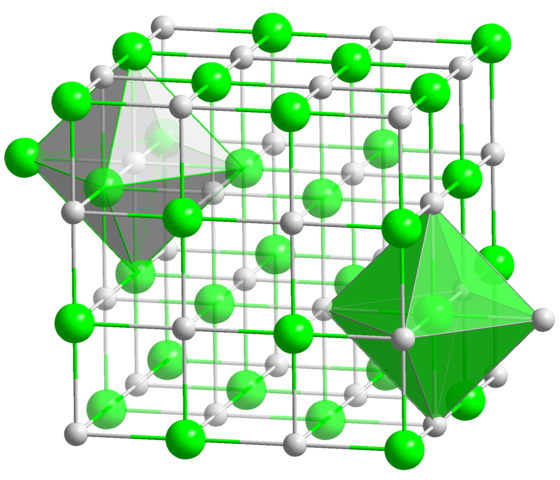 In de kristallijne structuur van de NaCl hebben elk Na+ -ion en Cl- zes buren, dus dit is het coördinatienummer voor beide ionen (zie de octaëder). Bron: Solid State / Public Domain
In de kristallijne structuur van de NaCl hebben elk Na+ -ion en Cl- zes buren, dus dit is het coördinatienummer voor beide ionen (zie de octaëder). Bron: Solid State / Public Domain Dit is verreweg het meest voorkomende coördinatienummer onder alle verbindingen. Onthoud het voorbeeld van de hoofdmunten. Maar in plaats van de favoriete geometrie is die van een platte zeshoek, komt overeen met die van de octaëder (normaal of vervormd), naast het trigonale prisma. Enkele van de vele voorbeelden van verbindingen met dit coördinatienummer zijn:
-[Alf6]3-
-[CO (NH3))6]3+
-[ZR (kies3))6]2-
-NaCl (ja, tafelzout)
-Mos2, Merk op dat c.N. Want deze verbinding is niet 2
Anderen
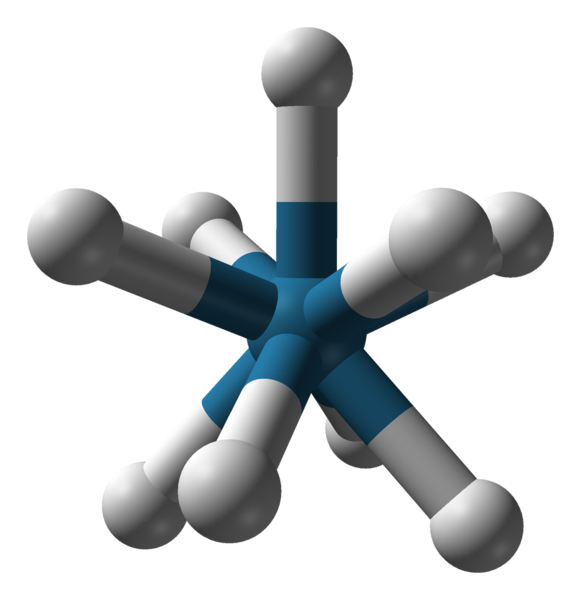 TripaDed Triapadic Prisma -geometrie van het anion [REH9] 2-. Bron: Benjah-BMM27 / Public Domain.
TripaDed Triapadic Prisma -geometrie van het anion [REH9] 2-. Bron: Benjah-BMM27 / Public Domain. Er zijn andere coördinatienummers, van 7 tot 15. Dus dat c.N. hoog zijn, het centrale ion of atoom moet erg groot zijn, weinig belasting hebben en tegelijkertijd moeten de liganden erg klein zijn. Enkele voorbeelden van verbindingen met dergelijke C.N. Ze zijn hieronder en eindigen:
-K3[NBOF6], C.N. 7 en octaedro geometrie
-[MO (CN)8]3-
-[ZR (ox)4]2-, os het oxalaatligand zijn
-[Reh9]2-
-[Frons3))6]2-, C.N. gelijk aan 12
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Coördinatiegetal. Opgehaald uit: in.Wikipedia.borg
- De redacteuren van Enyclopaedia Britannica. (S.F.)). Coördinatiegetal. Hersteld van: Britannica.com
- Profit. Robert J. Lancashire. (15 augustus 2020). Coördinatienummers en geometrie. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Helmestine, Anne Marie, pH.D. (28 augustus 2020). Coördinatienummerdefinitie in de chemie. Hersteld van: Thoughtco.com

