Nitrileigenschappen, nomenclatuur, gebruik, voorbeelden

- 4566
- 302
- Dewey Powlowski
De Nitriles Het zijn al die organische verbindingen met de CN -functionele groep, die ook wordt genoemd als een cyano -groep, of cyanide in termen van anorganische chemie. Alifatische nitrils worden weergegeven met de algemene formule van de RCN, terwijl aromatische nitrillen met de arcn -formule.
Hoewel waterstofcyanide, HCN en cyanidemetaalzouten zeer giftige verbindingen zijn, gebeurt er exact hetzelfde niet met nitrillen. De CN -groep in een koolstofskelet van welke aard dan ook (vertakt, lineair, aromatisch, enz.), het gedraagt zich diagonaal anders dan een cyanide -anion, CN-.
 Algemene formule voor een alifatische nitril. Bron: Benjah-bmm27 via Wikipedia.
Algemene formule voor een alifatische nitril. Bron: Benjah-bmm27 via Wikipedia. Nitrillen zijn erg verspreid in de wereld van kunststoffen, omdat verschillende van hen afkomstig zijn van acrilonitrile, CH2CHCN, een nitril waarmee polymeren worden gesynthetiseerd zoals nitril rubbers, gebruikt om een operatie of laboratoriumhandschoenen te maken. Nitrillen zijn ook aanwezig in veel natuurlijke en farmaceutische producten.
Aan de andere kant zijn nitrillen voorlopers van carbonzuren, omdat hun hydrolyse een alternatieve synthesemethode vertegenwoordigt om de laatste te verkrijgen.
[TOC]
Kenmerken en eigenschappen
Structuur
De moleculaire structuren van de nitrillen variëren afhankelijk van de identiteit van R of AR in respectievelijk de RCN- of Arcn -verbindingen.
De CN -groepsgeometrie is echter lineair vanwege de drievoudige link, C≡N, het product van SP -hybridisatie. Aldus bevinden C-C≡N-atomen zich in dezelfde lijn. Voorbij deze atomen kan er een structuur zijn.
Polariteit
Nitrillen zijn polaire verbindingen, omdat stikstof van de CN -groep zeer elektronegatief is en elektronen naar zichzelf aantrekt. Daarom hebben ze fusie- of kookpunten hoger dan hun homologen.
Het kan u van dienst zijn: Scandio: Geschiedenis, eigenschappen, reacties, risico's en gebruikBijvoorbeeld acetonitril, cho3CN, het is een vloeistof die kookt op 82 ºC; Terwijl etano, ch3Ch3, Het is een gas dat kookt op -89 ºC. Let op het grote effect dat de CN -groep heeft op intermoleculaire interacties.
Dezelfde redenering is van toepassing op grotere verbindingen: als ze een of meer CN -groepen in hun structuur hebben, is het zeer waarschijnlijk dat hun polariteit zal toenemen en meer gerelateerd zijn aan oppervlakken of polaire vloeistoffen.
Basiciteit
Men zou kunnen worden gedacht dat dit vanwege de hoge polariteit van nitrillen relatief sterke basen voor de amines zijn. We moeten echter rekening houden met de C≡N -covalente bindingen en het feit dat zowel koolstof als waterstof SP -hybridisatie hebben.
De basiciteit van de RCN: het wordt weergegeven door een proton uit het water te accepteren: water:
Rcn: + h2Of ⇌ rcnh+ + Oh-
Om het rcn te protoneren: het elektronenvrije koppel op de stikstof moet een link vormen met de ion h+. Maar er is een ongemak: stikstofhybridisatie maakt het te elektronegatief, zozeer dat dit paar elektronen zeer sterk wordt aangetrokken en zelfs geen binding toestaat om te vormen.
Daarom wordt gezegd dat het stikstofsperpaar stikstof niet beschikbaar is en dat de basiciteit van nitrillen erg laag is. In feite zijn nitrillen miljoenen keren minder eenvoudig dan amines.
Reactiviteit
Van de meest representatieve reacties van nitrillen hebben we hun hydrolyse en reductie. Deze hydrolyse wordt gemedieerd door de zuurgraad of basiciteit van de waterige omgeving, waardoor een carbonzuur of een carboxylaatzout respectievelijk veroorzaakt:
Kan u van dienst zijn: evenwicht tussen vloeistof en dampRCN + 2H2O + HCl → RCOOH + NH4Klet
RCN + H2O + NaOH → Rcona + NH3
In het proces wordt ook een amida gevormd.
Nitrillen worden gereduceerd tot amines met behulp van waterstof- en metaalkatalysatoren:
RCN → RCH2NH2
Nomenclatuur
Volgens de IUPAC -nomenclatuur worden Nitrils genoemd door het achtervoegsel -nitril toe te voegen aan de naam van de alkaanketen waaruit deze ontleent, inclusief de koolstof van de cyano. Dus cho3CN heet Ethanonitrilo en Cho3Ch2Ch2CN, butanonitril.
Ze kunnen ook worden aangesteld uit de naam van carbonzuur, dat wordt geëlimineerd door het woord 'zuur', en de achtervoegsels worden -oisch of -oico vervangen door het achtervoegsel -Onitril. Bijvoorbeeld voor ch3CN zou acetonitril zijn (azijnzuur); Voor C6H5CN, het zou benzonitril zijn (van benzoëzuur); En voor hem (Cho3))2CHCN, 2-methylpropanitril.
Als alternatief, als de namen van alquilicische substituenten worden overwogen, kunnen nitrillen worden vermeld met behulp van het woord 'cyanide'. Bijvoorbeeld cho3CN zou dan methylcyanide worden genoemd, en (cho3))2CHCN, isopropylcyanide.
Toepassingen
Nitrillen maken deel uit van natuurlijke producten, die in bittere amandelen zijn, in de botten van verschillende vruchten, in mariene dieren, planten en bacteriën.
De CN -groepen vormen de structuren van cyanogene lipiden en glycosiden, biomoleculen die wanneer afgebroken waterstofcyanide, HCN, een zeer giftig gas. Daarom hebben ze een dreigend biologisch gebruik voor bepaalde wezens.
Eerder werd gezegd dat CN -groepen veel polariteit geven aan de moleculen, en in feite blijven ze niet onopgemerkt wanneer ze aanwezig zijn in verbindingen met farmacologische activiteit. Dergelijke nitrilmedicijnen zijn gebruikt om hyperglykemie, borstkanker, diabetes, psychose, depressie en andere aandoeningen te bestrijden.
Kan u van dienst zijn: onomkeerbare reactie: kenmerken en voorbeeldenNaast een rol in de biologie en geneeskunde, vormen ze industrieel een handvol nitrilplastics, waarmee chirurgische en laboratoriumhandschoenen worden gemaakt, stempels van auto -onderdelen, slangen en gewrichten vanwege hun weerstand tegen corrosie en vetten, materialen zoals zoals materialen zoals zoals materialen, zoals materialen zoals zoals materialen zoals, Tupperware, muziekinstrumenten of LEGOS -blokken.
Nitril -voorbeelden
Volgende en uiteindelijk zullen enkele voorbeelden van nitrillen worden vermeld.
Nitril rubbers
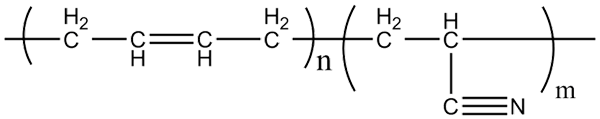 Moleculaire structuur van acrilonitril-butadieen copolymeren. Bron: Klever via Wikipedia.
Moleculaire structuur van acrilonitril-butadieen copolymeren. Bron: Klever via Wikipedia. Nitrilrubber, waarmee de bovengenoemde handschoenen en vetresistente materialen worden vervaardigd, is een copolymeer gevormd door acilonitril en butadieen (hierboven). Merk op hoe lineair de CN -groep eruit ziet.
Ciamemazine
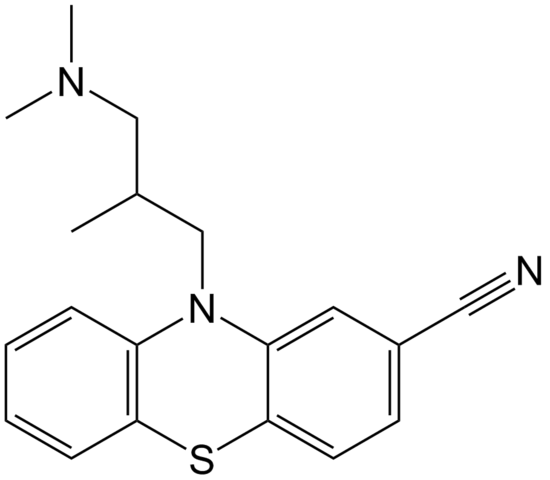 Moleculaire structuur van cipemazine. Bron: Epop / pub -domein
Moleculaire structuur van cipemazine. Bron: Epop / pub -domein Cyammazine is een voorbeeld van een nitril in het apotheekgebied dat wordt gebruikt als antipsychotisch, met name om angst en schizofrenie -aandoeningen te behandelen. Let nogmaals op de lineariteit van de CN -groep.
Citalopram
 Een ander nitrilgeneesmiddel is citalopram, gebruikt als een antidepressivum
Een ander nitrilgeneesmiddel is citalopram, gebruikt als een antidepressivum Amygdalin
 Moleculaire structuur van de tonsiline. Bron: Wesalius / Public Domain
Moleculaire structuur van de tonsiline. Bron: Wesalius / Public Domain De tonsil is een voorbeeld van een cyanogene glucóside. Het wordt gevonden in bittere amandelen, pruimen, abrikozen en perziken. Merk op hoe klein de CN -groep eruit ziet met betrekking tot de rest van de structuur; Toch is de enige aanwezigheid ervan voldoende om een unieke chemische identiteit te bieden aan deze koolhydraten.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Nitril. Opgehaald uit: in.Wikipedia.borg
- Chemistry Libhethexts. (5 juni 2019). Chemie van nitriles. Hersteld van: chem.Librhetxts.borg
- Jim Clark. (2016). Hydrolyserende nitriles. Hersteld van: chemguide.co.Uk
- Ivy Rose holistisch. (2020). Nitrile naamgeving. Opgehaald uit: ivyrose.com
- Germán Fernández. (S.F.)). Nitril -nomenclatuur: IUPAC -regels. Hersteld van: chemicicaorganica.borg
- « De 8 belangrijkste psychologische stromingen en hun auteurs
- Metilamine -structuur, eigenschappen, productie, gebruik »

