Metilamine -structuur, eigenschappen, productie, gebruik
- 1923
- 198
- Nathan Wiegand
De Metilamine Het is een organische verbinding waarvan de gecondenseerde formule cho is3NH2. In het bijzonder is het het eenvoudigste primaire alkyamine van allemaal, omdat het alleen een alquilisch substituent bevat, wat hetzelfde is als zeggen dat er slechts één C-N covalent link is.
Onder normale omstandigheden is het een ammoniakgas dat naar vis ruikt, maar dat is relatief gemakkelijk te condenseren en transport in hermetische tanks. Evenzo kan het aanzienlijk worden opgelost in water, waardoor geelachtige oplossingen worden veroorzaakt. Aan de andere kant kan het ook als vast worden getransporteerd in de vorm van uw hydrochloridezout, CH3NH2· HCl.
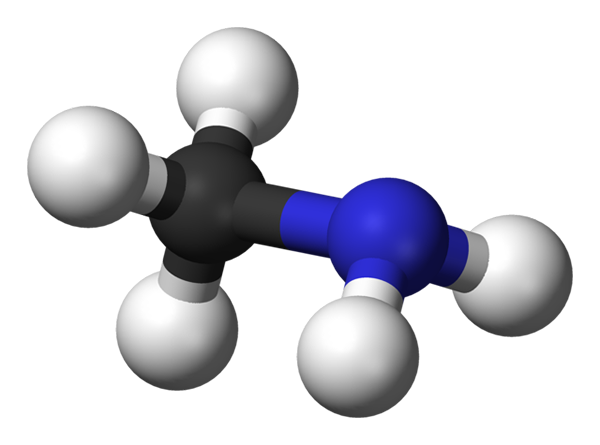
 Metilaminemolecuul. Bron: Benjah-bmm27 via Wikipedia.
Metilaminemolecuul. Bron: Benjah-bmm27 via Wikipedia. Metilamine komt industrieel voor bij ammoniak en methanol, hoewel er veel andere productiemethoden zijn op laboratoriumschalen. Het gas is zeer explosief, dus elke warmtebron die er dichtbij komt, kan een geweldig vuur veroorzaken.
Het is een samenstelling met een hoge commerciële vraag, maar tegelijkertijd biedt het sterke wettelijke beperkingen omdat het dient als grondstof voor drugs en psychotrope stoffen.
[TOC]
Structuur
Het bovenstaande beeld toont de moleculaire structuur van het methylamine dat wordt weergegeven door een model van bollen en staven. De zwarte bol komt overeen met het koolstofatoom, het blauwe met het stikstofatoom en het wit tot de waterstofatomen. Het is daarom een klein molecuul, waar methaan, cho4, Verlies een H voor een NH -groep2, Geven ch3NH2.
Metilamine is een zeer polair molecuul, omdat stikstofatoom elektronische koolstofdichtheid en waterstofatomen aantrekt. Het heeft het vermogen om ook waterstofbruggen te vormen tussen het compendium van zijn intermoleculaire krachten. Elk molecuul van CH3NH2 U kunt een opeenvolgende waterstofbrug doneren of accepteren (CH3Hnh-nh2Ch3)).
Kan je van dienst zijn: wat is bandtheorie?De moleculaire massa is echter aanzienlijk laag, naast de poorten CH3 Ze belemmeren dergelijke waterstofbruggen. Het resultaat is dat methylamine een gas is in normale omstandigheden, maar dat kan worden gecondenseerd bij een temperatuur van -6 ºC. Bij het kristalliseren is dit na een ortorrombische structuur.
Eigenschappen
Fysiek uiterlijk
Kleurrijk gas of vloeistof, maar waarvan de waterige oplossingen geelachtige tonen kunnen presenteren.
Geur
Onaangenaam, vergelijkbaar met die van een mengsel van vis en ammoniak.
Molaire massa
31,058 g/mol
Smeltpunt
-93.10 ºC
Kookpunt
Rond de -6 ºC. Daarom is het een gas dat kan condenseren bij niet al te koude temperaturen.
Dikte
656.2 kg/m3 bij 25 ºC. De dampen zijn 1,1 keer dicht dan lucht, terwijl het vloeistof of condensaat ongeveer 0,89 keer minder dicht is dan water.
Dampdruk
Bij kamertemperatuur varieert uw dampdruk 3,5 atm.
Dipolair moment
1.31 D
Oplosbaarheid in water
1.080 g/l bij 20 ºC. Het is een gas dat zeer goed oplost in water, omdat beide moleculen polair zijn en aan elkaar gerelateerd zijn bij het opzetten van waterstofbruggen (CH3Hnh-oh2)).
Basiciteit
Metilamine heeft een basicality -constante (PKB) van 3,36. Deze waarde geeft aan dat het een aanzienlijk eenvoudige substantie is, zelfs meer dan dezelfde ammoniak, zodat het opgelost in water een bepaalde hoeveelheid OH -ionen vrijgeeft- Wanneer gehydrolyseerd:
Ch3NH2 + H2Of ⇌ ch3NH3+ + Oh-
Metilamine is eenvoudiger dan ammoniak omdat het stikstofatoom een grotere elektronische dichtheid heeft. Dit komt omdat Cho3 Meer stikstofelektronen gedaan dan de drie waterstofatomen in de NH -molecuul3. Toch wordt methyilamine beschouwd als een zwakke basis voor andere alkyamines of amines.
Kan u van dienst zijn: CO2 LinktypeFlitspunt
-10 ºC tot een gesloten beker, wat betekent dat het een zeer ontvlambaar en gevaarlijk gas is.
Zelf -richtingtemperatuur
430 ºC
Oppervlaktespanning
19.15 mn/m A 25 ºC
Ontleding
Wanneer het brandt, wordt het thermisch ontbonden in koolstof- en stikstofoxiden, die een giftige rook vormen.
Productie
Metilamine kan worden geproduceerd of gesynthetiseerd door de commerciële of industriële methode, of door laboratoriummethoden op lagere schalen.
Industrieel
Metilamine vindt industrieel plaats door de reactie die plaatsvindt tussen ammoniak en methanol op een katalytische sympathische gelondersteuning. De chemische vergelijking voor deze reactie is als volgt:
Ch3OH + NH3 → ch3NH2 + H2OF
In het proces kunnen andere alkamines worden gegenereerd; Methyilamine is echter het product dat cinenetisch meer gunstig lijkt.
Laboratorium
Op laboratoriumniveau zijn er verschillende methoden die het synthetiseren van kleinschalige methylamine mogelijk maken. Een van hen is de reactie in een sterk basismedium, van KOH, tussen acetamide en broom, waarbij methylisocianaat wordt gegenereerd, ch3NCO, dat op zijn beurt wordt gehydrolyseerd om methylatie te worden.
Metilamine kan worden opgeslagen als een vaste stof als het wordt geneutraliseerd met zoutzuur, zodat een hydrochloridezout wordt gevormd:
Ch3NH2 + HCl → CH3NH2· HCl
Vervolgens wordt ook methylaminehydrochloride weergegeven als [CH3NH3] CL, kan gebaseerd zijn op een veilige plek om de waterige oplossing te verkrijgen met opgelost gas:
[Ch3NH3] CL + NaOH → CH3NH2 + NaCl + H2OF
Aan de andere kant kan methylamine ook worden gesynthetiseerd uit hexamine (CH2))6N4, die direct wordt gehydrolyseerd met zoutzuur:
Kan u van dienst zijn: kristallisatie(Ch2))6N4 + HCl + 6 H2O → 4 NH4CL + 6 CH2OF
Opeenvolgend reageert ammoniumchloride met hete formaldehyde om methyilamine en mierenzuurdampen te veroorzaken, hcooh.
Ook kan methylamine worden verkregen door nitromethaan, CH te verminderen3NEE2 met metalen zink en zoutzuur.
Toepassingen
 Ephedrine is een medicijn dat methyilamine nodig heeft voor commerciële productie. Bron: Turkije.
Ephedrine is een medicijn dat methyilamine nodig heeft voor commerciële productie. Bron: Turkije. Metilamine is een verbinding waarvan het gebruik meestal controverse genereert, omdat het een stof is die wordt gebruikt in de synthese van verdovende middelen zoals methamfetamine. In feite is de populariteit te wijten aan de wens dat de hoofdrolspelers van de Breaking Bad Television Series het koste wat het kost moesten krijgen.
Deze verbinding wordt ook gebruikt als grondstof voor de productie van insecticiden, medicijnen, oppervlakteactieve stoffen, explosieven, kleurstoffen, fungiciden, additieven, enz., Het heeft dus een sterke wereldvraag, naast meerdere wettelijke beperkingen voor de acquisitie.
De immense chemische veelzijdigheid is te wijten aan het MO -molecuul3NH2 Het is een goed nucleofiel middel, gekoppeld of gecoördineerd met substraten van grotere moleculaire massa in verschillende organische reacties. Dit is bijvoorbeeld gebaseerd op de synthese van de efedrine, waar cho3NH2 Het sluit zich aan bij een molecuul met het daaruit voortvloeiende verlies van een h.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Methylamine. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Methylamine. PubChem -database., CID = 6329. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Dylan Matthews. (15 augustus 2013). Dit is wat 'Breaking Bad' goed en fout is over de meth -business. Hersteld van: WashingtonPost.com
- Prepchem. (2020). Bereiding van methylaminehydrochloride. Hersteld van: prapchem.com
- « Nitrileigenschappen, nomenclatuur, gebruik, voorbeelden
- Politieke organisatie van de Azteken van macht »

