Zinknitraatstructuur, eigenschappen, verkrijgen, gebruik

- 1800
- 64
- Aaron Okuneva
Hij zinknitraat Het is een anorganische verbinding gevormd door het zink (Zn), stikstof (N) en zuurstof (O) elementen (O). De oxidatiestatus van het zink is +2, die van stikstof is +5 en zuurstof is -2.
De chemische formule is Zn (nee3))2. Het is een vaste kleurloze kristallijn die de neiging heeft om water uit de omgeving te absorberen. Het kan worden verkregen door het zinkmetaal te behandelen met verdund salpeterzuur. Het is een sterk oxiderende verbinding.
 FIFR Zn nitraat (nee3))2. Ondřej Mangl / Pub -domein. Bron: Wikimedia Commons.
FIFR Zn nitraat (nee3))2. Ondřej Mangl / Pub -domein. Bron: Wikimedia Commons. Het dient als een organische chemie -reacties versneller en stelt u in staat om samengestelde polymeren te verkrijgen met elektriciteitsstoornissen. Het wordt gebruikt om lagen van nuttige materialen in elektronica te vormen.
Het maakt deel uit van sommige vloeibare meststoffen en bepaalde trage herbiciden. Help bij het bereiden van complexe oxiden die uw dichtheid en elektrische geleidbaarheid verbeteren.
Het is met succes getest bij het verkrijgen van structuren die dienen als basis voor regeneratie en groei van botweefsel, waardoor dit proces wordt verbeterd en resulteert in een antibacteriële.
Hoewel het geen brandstof is, kan het het verbranden van stoffen versnellen, zoals kolen of organische materialen. Het irriteert de huid, ogen en slijmvliezen en is zeer giftig voor het waterleven.
[TOC]
Structuur
Zinknitraat is een ionische verbinding. Het heeft een tweekleppig kation (Zn2+) en twee monovalente anionen (nee3-)). Nitraatanion is een polyiatomisch ion gevormd door een stikstofatoom in zijn oxidatietoestand +5 verbonden aan drie zuurstofatomen met Valencia van -2.
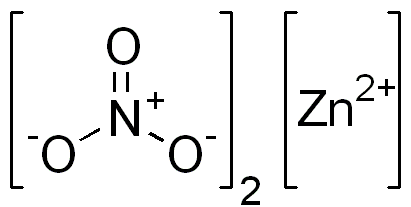 Ionische nitraatstructuur van zink. Edgar181 / pub -domein. Bron: Wikimedia Commons.
Ionische nitraatstructuur van zink. Edgar181 / pub -domein. Bron: Wikimedia Commons. De onderstaande afbeelding toont de ruimtelijke structuur van deze verbinding. De grijze centrale bol is zink, blauwe bollen zijn stikstof en rode bollen vertegenwoordigen zuurstof.
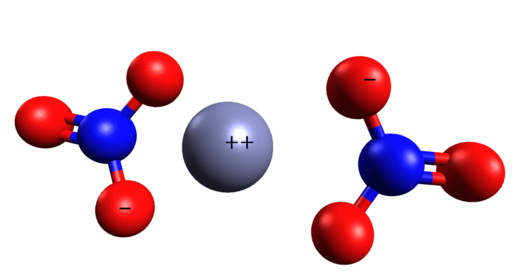 Ruimtelijke structuur van Zn (nee3))2. CINC zit in het midden van nitraationen. Grasso luigi/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Ruimtelijke structuur van Zn (nee3))2. CINC zit in het midden van nitraationen. Grasso luigi/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Nomenclatuur
- CINC -nitraat
- Zink dinitraat
Eigenschappen
Fysieke staat
Kleurloze vaste of kristallijn wit.
Molecuulgewicht
189.40 g/mol
Smeltpunt
Ongeveer 110 ºC.
Het kan u van dienst zijn: iarhydric Acid (HI): structuur, eigenschappen en gebruikKookpunt
Ongeveer 125 ºC.
Dikte
2.065 g/cm3
Oplosbaarheid
Water oplosbaar: 120 g/100 g h h2Of bij 25 ° C. Oplosbaar alcohol.
pH
De waterige oplossingen zijn zuur. Een oplossing van 5% heeft een pH van ongeveer 5.
Chemische eigenschappen
Om een nitraat te zijn, is deze verbinding een sterk oxidatiemiddel. Reageert heftig met steenkool, koper, metalen sulfiden, organisch materiaal, fosfor en zwavel. Als het wordt gespoten op hete kolene exploits.
Aan de andere kant is het hygroscopisch en absorbeert water uit de omgeving. Als zinkoxide vormt, stikstof- en zuurstofdioxide:
2 Zn (nee3))2 + Verwarm → 2 ZnO + 4 Nee2↑ + o2↑
In alkalische oplossingen, zoals die van NaOH, vormt het zink van deze verbinding zijn hydroxide en andere complexe soorten:
Zn (nee3))2 + 2 oh- → Zn (OH)2 + 2 Nee3-
Zn (OH)2 + 2 oh- → [Zn (OH)4]2-
Het verkrijgen van
Het kan worden verkregen door zink- of zinkoxide te behandelen met verdund salpeterzuur. Waterstofgas wordt in deze reactie gevormd.
Zn + 2 hno3 → Zn (nee3))2 + H2↑
Toepassingen
Reacties katalyse
Het wordt gebruikt als een katalysator bij het verkrijgen van andere chemische verbindingen zoals harsen en polymeren. Het is een zuurkatalysator.
 Hars Voorbeeld. Bugman bij Engelse Wikipedia / Public Domain. Bron: Wikimedia Commons.
Hars Voorbeeld. Bugman bij Engelse Wikipedia / Public Domain. Bron: Wikimedia Commons.  Polymeerstructuurmodel. Ilmari Karonen / Pub -domein. Bron: Wikimedia Commons.
Polymeerstructuurmodel. Ilmari Karonen / Pub -domein. Bron: Wikimedia Commons. Een ander geval van reacties versnelling is het katalytische systeem van Zn (nee3))2/Voc2OF4, waardoor de oxidatie van a-hydrolyters tot a-zo-stresssen met 99% conversie mogelijk maakt, zelfs bij omgevingsdruk en temperatuur.
In samengestelde polymeren
Polymethylmetacrylaat en Zn -films zijn ontwikkeld (nee3))2 met elektrische geleidbaarheidseigenschappen waardoor ze geschikte kandidaten maken om te gebruiken in supercapaces en computers met een hoge snelheid.
In oxystcement
Met waterige zinknitraatoplossingen en zinkoxidepoeder worden materialen die behoren tot de klasse van cementen die worden gegenereerd door een zuur-base reactie verkregen.
Deze hebben een redelijke weerstand om op te lossen in verdunde zuren en alkalisten, waardoor compressieweerstandscompressie wordt ontwikkeld in vergelijking met ander cement.
Deze eigenschap neemt toe wanneer de ZnO/Zn -verhouding wordt verhoogd (nee3))2, En wanneer de Zn -concentratie wordt geüpload (nee3))2 In de oplossing. De verkregen cement zijn volledig amorf, dat wil zeggen dat ze geen kristallen hebben.
Kan u van dienst zijn: chemische neerslag Met zinknitraat zijn tests voor het verkrijgen van cements uitgevoerd. Auteur: Kobthanapong. Bron: Pixabay.
Met zinknitraat zijn tests voor het verkrijgen van cements uitgevoerd. Auteur: Kobthanapong. Bron: Pixabay. In coatings en nanomaterialen van zinkoxide
De Zn (nee3))2 Het wordt gebruikt voor elektrolytische afzetting van zeer dunne lagen zinkoxide (ZnO) op verschillende substraten. Nanostructuren van dit oxide worden ook bereid op de oppervlakken.
 Zinkoxide nanodeeltjes. Sommige ZnO -nanostructuren kunnen worden voorbereid met Zn (nee3))2. Verena Wilhelmi, Ute Fischer, Heike weegardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC door (https: // creativeCommons.Org/licenties/door/2.5). Bron: Wikimedia Commons.
Zinkoxide nanodeeltjes. Sommige ZnO -nanostructuren kunnen worden voorbereid met Zn (nee3))2. Verena Wilhelmi, Ute Fischer, Heike weegardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC door (https: // creativeCommons.Org/licenties/door/2.5). Bron: Wikimedia Commons. ZnO is een materiaal van groot belang vanwege de veelheid aan toepassingen op het gebied van optolectronica, het heeft ook halfgeleider -eigenschappen en wordt gebruikt in sensoren en transducers.
In herbiciden
CINC -nitraat is samen met enkele organische verbindingen gebruikt om de afgiftesnelheid van bepaalde herbiciden in water te verminderen. Met de langzame afgifte van deze producten kunnen ze beschikbaar zijn voor langere en minder toepassingen zijn vereist.
In Anod Manufacturing
Stimuleert het sinterproces en verbetert de dichtheid van bepaalde oxiden die dienen om anods te maken voor brandstofcellen. Sinteren is het verkrijgen van een vast materiaal door de verwarming en compressie van een poeder zonder de fusie te bereiken.
 Tekenen hoe twee korrels sinteren plaatsvindt. De Zn (nee3))2 Help bij de uitvoering van dit proces op sommige complexe oxiden. Cdang / pub domein. Bron: Wikimedia Commons.
Tekenen hoe twee korrels sinteren plaatsvindt. De Zn (nee3))2 Help bij de uitvoering van dit proces op sommige complexe oxiden. Cdang / pub domein. Bron: Wikimedia Commons. De materialen waarin de tests zijn uitgevoerd, zijn complexe oxiden van strontium, iridium, ijzer en titanium. De aanwezigheid van FAL verhoogt de elektrische geleidbaarheid hiervan aanzienlijk.
Andere apps
Het wordt gebruikt bij het verkrijgen van medicijnen. Het fungeert als een bijtend in de toepassing van inkten en kleurstoffen. Dient als latex coagulant. Het is een bron van zink en stikstof in vloeibare meststoffen.
Potentieel gebruik in botweefseltechniek
Deze verbinding is gebruikt als een additief bij de uitwerking van pantser of frames voor de regeneratie van botvezels, omdat het het mogelijk maakt om de mechanische weerstand van deze structuren te verbeteren.
Kan u van dienst zijn: Germanio: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikEr is waargenomen dat de steiger die fift bevat niet giftig is voor osteoprogenitorcellen, ondersteunt de activiteit van osteoblasten die de cellen zijn die bot produceren en hun hechting en proliferatie verbeteren.
Funeert de vorming van apatita dat het mineraal is dat de botten vormt en ook een antibacterieel effect uitoefent.
 De Zn (nee3))2 Het kan erg nuttig zijn voor de reconstructie van botmateriaal bij mensen die ongevallen hebben geleden. Mariano Coretti/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
De Zn (nee3))2 Het kan erg nuttig zijn voor de reconstructie van botmateriaal bij mensen die ongevallen hebben geleden. Mariano Coretti/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Risico's
Het is een materiaal met een potentieel risico op vuur en explosie.
Het is geen brandstof maar versnelt het verbranden van brandbare materialen. Als een grote hoeveelheid van deze verbinding betrokken is bij een brand of als het brandbare materiaal fijn is verdeeld, kan een explosie optreden.
Wanneer ze worden onderworpen aan sterke warmte, worden giftige stikstofoxiden geproduceerd. En als de belichting wordt uitgevoerd, kan deze exploderen.
Het is irritant voor de huid, het kan ernstige schade aan de ogen, irritatie in de luchtwegen veroorzaken, het is giftig vanwege inname en veroorzaakt schade aan het spijsverteringskanaal.
Zeer giftig voor het waterleven met effecten die duren.
Referenties
- Ju, en. et al. (2019). Nieuw effect van zinknitraat/vanadyloxalaat voor selectieve katalytische oxidatie van alfa-hydroxyesters op alfa-keto esers met moleculaire zuurstof: een in situ. Moleculen 2019, 24, 1281. MDPI hersteld.com.
- Mohd s., S.N. et al. (2020). Gecontroleerde afgifte formulering van zinkhydroxide nitraat geïntercaleerd met natriumdodecylsulphe en bispyribac anionen: een nieuw herbicide nanocomposiet voor paddy -teeltivatie. Arabian Journal of Chemistry 13, 4513-4527 (2020). Hersteld van Scientedirect.
- Man, m.P. et al. (2019). Verrijkte mechanische sterkte en botmineralisatie van elektrospun biomimetische steiger beladen met ylang ylang olie en zinknitraat voor botweefseltechniek. Polymeren 2019, 11, 1323. MDPI hersteld.com.
- Kim, K.Je. et al. (2018). Effecten van zinknitraat als een sinterhulp op de electochemische kenmerken van SR0,92EN0,08Oom3-delta en meneer0,92EN0,08Jij0,6Vertrouwen0,4OF3-delta Ceramics International, 44 (4): 4262-4270 (2018). Hersteld van Scientedirect.com.
- Prasad, B.EN. et al. (2012). Elektrodepositie van ZnO -coating van waterige Zn (nee3))2 Baden: effect van Zn -concentratie, temperatuurafzetting en tijd op oriëntatie. J Solid State Electochem 16, 3715-3722 (2012). Link hersteld.Springer.com.
- Bahadur, h. en srivastava,.K. (2007). Morfologieën van Sol-gel ontierde dunne films van ZnO met behulp van verschillende voorlopermaterialen en hun nanostructuren. Nanoscale Res Lett (2007) 2: 469-475. Link hersteld.Springer.com.
- Nicholson, J.W. en Tibaldi, J.P. (1992). Vorming en eigenschappen van cement bereid uit zinkoxide en waterige oplossingen van zinknitraat. J Mater Sci 27, 2420-2422 (1992). Link hersteld.Springer.com.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Maji, p. et al. (2015). Effect van Zn (nee3))2 Vulstof op de diëlektrische demilliteit en elektrische modulus van PMMA. Bull Mater Sci 38, 417-424 (2015). Link hersteld.Springer.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Zinknitraat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Byju's. (2020). Zinknitraat - Zn (NO3) 2. Hersteld van byjus.com.
- Amerikaanse elementen. Zinknitraat. Hersteld van Amerikanen.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- « Zinkchloride (ZnCl2) structuur, eigenschappen, verkrijgen, gebruik
- Concrete gevallen van ethische procedure in instellingen en organisaties »

