Zinkchloride (ZnCl2) structuur, eigenschappen, verkrijgen, gebruik

- 1657
- 105
- Dr. Rickey Hudson
Hij zinkchloride Het is een anorganische verbinding gevormd door het zink- of zinkelement (Zn) en chloor (CL). De chemische formule is ZnCl2. CINC wordt gevonden in de oxidatietoestand +2 en chloor heeft een Valencia van -1.
Het is een kleurloze of witte kristallijne vaste stof. Het is zeer oplosbaar in water en absorbeert het gemakkelijk uit de omgeving, die te zien is in de figuur van de bevochtigde vaste stof die hieronder wordt getoond.
 Fifcl chloride2 Solid enigszins gehydrateerd. Gebruiker: Walkerma / Public Domain. Bron: Wikimedia Commons.
Fifcl chloride2 Solid enigszins gehydrateerd. Gebruiker: Walkerma / Public Domain. Bron: Wikimedia Commons. Het zink van deze verbinding is biologisch zeer belangrijk voor mensen, dieren en planten, omdat het tussenbeide komt in basisfuncties zoals eiwitten en vetsynthese.
Om deze reden de ZNCL2 Het wordt gebruikt als een voedingscomplement voor dieren en mensen in gevallen van zinktekort, en als een micronutriënt voor planten.
Het heeft bacteriostatische en samentrekkende eigenschappen en wordt veel gebruikt voor deze doeleinden in zowel menselijke als veterinaire geneeskunde. Elimineert ook ongedierte zoals buitenschimmels en is intermediair om pesticiden te verkrijgen.
Van zijn meervoudige toepassingen dient het om cellulose- en wolvezels in verschillende processen te behandelen, en om ze voor te bereiden op kleur of afdrukken. Stel ook de verbranding van hout uit.
[TOC]
Structuur
De ZnCl2 Het is een ionische verbinding gevormd door het Zn -kation2+ en twee anions chloride cl- die binden door elektrostatische krachten.
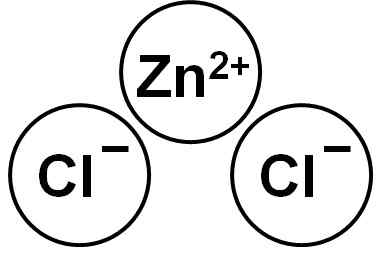 Zinkchloride. Auteur: Marilú Stea.
Zinkchloride. Auteur: Marilú Stea. Het zink (II) ion heeft de volgende elektronische structuur:
1s2, 2s2 2 p6, 3S2 3P6 3D10, 4S0,
waarin wordt opgemerkt dat beide elektronen van de cape 4S, waarbij de configuratie stabiel is.
Het chloride -ion presenteert de volgende structuur:
1s2, 2s2, 2 p6, 3S2 3P6,
die ook erg stabiel is voor het hebben van volledige orbitalen.
In de figuur kan de manier waarop de ionen beschikbaar zijn in het glas worden waargenomen. Grijze bollen vertegenwoordigen zink- en groene bollen van chloor.
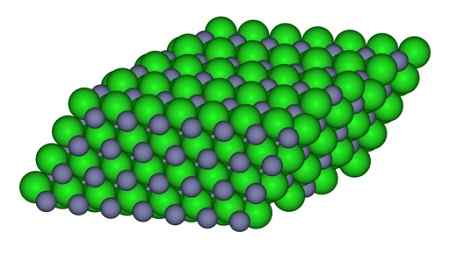 Structuur die de ionen vormt in het ZnCl -kristal2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Structuur die de ionen vormt in het ZnCl -kristal2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. Nomenclatuur
- Zinkchloride (ii)
- Zinkdichloride
Eigenschappen
Fysieke staat
Kleurloze vaste of kristallijn wit. Zeshoekige kristallen.
Molecuulgewicht
136.3 g/mol
Smeltpunt
290 ºC
Kookpunt
732 ºC
Dikte
2,907 g/cm3 bij 25 ° C
Oplosbaarheid
Zeer oplosbaar in water: 432 g/100 g h2Of bij 25 ° C, 614 g/100 g h H2Of 100 ° C. Zeer oplosbaar in zoutzuur (HCL), alcohol en glycerol. Helemaal mengbaar.
Kan u van dienst zijn: Mercury Hydroxide: structuur, eigenschappen, gebruik, risico'spH
De waterige oplossingen zijn zuur. Een oplossing van 6 mol ZnCl2/L heeft een pH van 1,0.
Chemische eigenschappen
Het is een hygroscopische en delicoscent -verbinding, omdat het in contact met de vochtigheid van de omgeving veel water absorbeert. In water wordt het gehydrolyseerd en heeft het de neiging om een basic onoplosbare van zinkoxychloride te vormen.
Reageert met zinkoxide (ZnO) in water die zinkoxychloriden genereert die een extreem hard -type cementmateriaal vormen.
Het is voorzichtig corrosief tegenover metalen.
Het is niet ontvlambaar.
Biologische rol
Biologisch zink is een van de belangrijkste elementen. Het is erkend als essentieel voor alle manieren van leven.
In het menselijk lichaam de ZnCl2 Zn biedt, wat essentieel is voor eiwitten, cholesterol en vetsynthese. Vooral CINC is belangrijk voor de juiste werking van het immuunsysteem.
 De zink Zncl2 Het is belangrijk voor celdeling in levende wezens. Ladyofhats / Public Domain. Bron: Wikimedia Commons.
De zink Zncl2 Het is belangrijk voor celdeling in levende wezens. Ladyofhats / Public Domain. Bron: Wikimedia Commons. Meer dan 25 eiwitten die zink bevatten, zijn geïdentificeerd, en veel van deze zijn enzymen, noodzakelijk in celdeling en groei, en voor de afgifte van vitamine A uit de lever.
CINC -tekort kan leiden tot groei in groei, depressieve mentale functie, anorexia, dermatitis, afname van immuniteit, diarree en slecht nachtzicht, onder andere aandoeningen.
Het verkrijgen van
Commercieel wordt deze verbinding bereid door waterig zoutzuur te reageren met schroot, zinkafval of met het mineraal dat het bevat. In deze reactie is er ook gaswaterstof (h2)).
Het behandelen van zink met waterstofchloride bij 700 ° C wordt verkregen.
Zn + HCl → ZnCl2 + H2↑
Toepassingen
In therapeutische behandelingen
Het is een zachte of bacteriostatische antibacteriële, dus het wordt gebruikt in vaginale douches om tricomonas of hemophilus -infecties te elimineren. Het dient ook om eelt te behandelen, als een samentrekkende en in chemiocirugia bij huidkanker.
Het wordt gebruikt als samentrekkend in sommige cosmetica, zoals verfrissende lotions voor de huid.
Als voedingssupplement
Vanwege het belang ervan in verschillende functies van het menselijk organisme2 Het wordt oraal toegediend als onderdeel van voedingsaccessoires en ook bij mensen die parenteraal voedsel nodig hebben.
ZnCl -supplementen2 Ze worden geleverd om de zone te behandelen.
Kan u van dienst zijn: homogene mengsel ZnCl -supplementen2 Ze moeten worden gebruikt wanneer er zinktekort is. Auteur: Moakets. Bron: Pixabay.
ZnCl -supplementen2 Ze moeten worden gebruikt wanneer er zinktekort is. Auteur: Moakets. Bron: Pixabay. Gezonde individuen verwerven het door voedsel.
Het moet minimaal 1 uur voor de maaltijd of 2 uur daarna worden geleverd, omdat sommige voedingsmiddelen hun absorptie kunnen voorkomen. Bij patiënten die maagirritatie hebben na aanvulling inname zou het moeten innemen met de maaltijd, maar op deze manier zal het zink minder biodispononisch zijn.
In veterinaire toepassingen
De oplossingen zijn bij dieren gebruikt als een bijtend middel om fistels te verbranden of Caulbody, die verbindingen zijn tussen organen die niet normaal of gezond zijn; In de vorm van pasta dient het om zweren en chemotherapie van kanker te behandelen.
 De waterige oplossingen van ZnCl2 Ze worden gebruikt om infecties van dieren ogen te behandelen. Auteur: Mabel Amber. Bron: Pixabay.
De waterige oplossingen van ZnCl2 Ze worden gebruikt om infecties van dieren ogen te behandelen. Auteur: Mabel Amber. Bron: Pixabay. Bij ooginfecties werkt een zeer verdunde oplossing van deze verbinding als een antiseptisch en samentrekkend.
Het wordt ook gebruikt als sporen in diervoeding of als een voedingssupplement.
In speciale cement
De reactie tussen de ZnCl2 En de ZnO in water produceert wat zinkoxychloride dat een extreem hard of cementmateriaal uitmaakt. De belangrijkste bestanddelen zijn 4zno • ZnCl2• 5h2O en ZnO • ZnCl2• 2h2OF.
Dit type cement is bestand tegen de aanval van zuur of kokend water. De pentahydraat is echter zeer stabiel en onoplosbaar maar onveranderlijk, en het dihydraat is meer oplosbaar en kan vloeibare drainage veroorzaken.
Om deze redenen hebben deze cement weinig toepassingen.
Als katalysator
Het dient om enkele organische chemische reacties te versnellen. Fungeert als condensor -agent. Bij bijvoorbeeld aldolische reacties, aminatiereacties en cyclus -toevoegingsreacties. In sommige van deze handelingen als een radicale initiator.
Het is een Lewis-zuur en katalyseert Diels-Alder-reacties. Het wordt ook gebruikt als een katalysator in Friedel-Crafts-reacties, om kleurstoffen en kleurstoffen te produceren, en bij de vervaardiging van polyester-politieke harsen.
Hieronder is een reactie waarin deze verbinding tussenbeide komt:
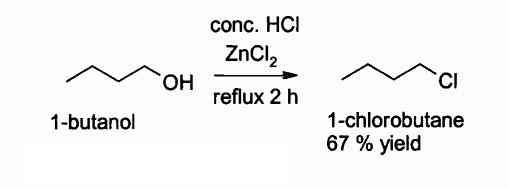 Reactie van het verkrijgen van een alkylchloride met behulp van ZnCl2. Auteur: Walkerma. Bron: Wikimedia Commons.
Reactie van het verkrijgen van een alkylchloride met behulp van ZnCl2. Auteur: Walkerma. Bron: Wikimedia Commons. In landbouwactiviteiten
Het is gebruikt als een herbicide in gewassen, als een bladbehandeling, om ongedierte zoals schimmels en mos te elimineren, en als een micronutriënt. Het is intermediair om pesticiden voor te bereiden.
In tandheelkundige toepassingen
Het wordt gebruikt in mondspoelen, maar de aanbevolen contacttijd is erg kort, dus het werkt alleen als samentrekkend in het mondslijmvlies. Het dient als desensibilisator, het wordt gebruikt in dentifric pasta's en maakt deel uit van tandheelkundige cement.
Kan u van dienst zijn: natriumchloriet (NaClo2): structuur, eigenschappen, gebruik, risico'sIn de textiel- en papierindustrie
Het is een ingrediënt van het oplosmiddel dat wordt gebruikt bij de productie van rayon of kunstmatige zijde uit cellulose. Het is een reticulatie of vakbondsagent voor harsen die op textiel eindigen. Het dient ook om hen te behandelen en hun behoud te bevorderen.
Het maakt het mogelijk om stoffen, scheidende zijde- en wollenvezels te krullen en fungeert als een bijtende afdrukken en kleuring van textiel.
Het wordt gebruikt bij de productie van papieren rollen en om crêpepapier te produceren.
Bij de voorbereiding van nanodeeltjes
Door zinkchloride te reageren met natriumsulfide (NA2S) door een sonochemische methode en in aanwezigheid van bepaalde organische verbindingen worden nanodeeltjes van zinksulfide (ZnS) verkregen. Sonochemische methoden gebruiken geluidsgolven om chemische reacties te veroorzaken.
Dit type nanomaterialen kan toepassing hebben als fotokatalytische middelen om bijvoorbeeld de verdeling van water in zijn componenten (waterstof en zuurstof) te produceren door de werking van licht.
In verschillende toepassingen
- Deodorant, antiseptisch en ontsmettingsmiddel van gebieden. Mos-, schimmel- en schimmelsregeling in buiten aangrenzende structuren en gebieden zoals trottoirs, binnenplaatsen en hekken. Desinfecterend middel van toiletten, urine, tapijten en gecomprimeerd hout.
- Gebruikt in mengsels voor embalmar en oplossingen voor het behoud van anatomische monsters.
- Houten vlamvertrager.
- Primair ingrediënt in rookpompen die worden gebruikt om een veelheid van mensen te verspreiden; Brandweerlieden gebruiken ze in vuurgevechtoefeningen en -praktijken.
 CINC -chloride wordt gebruikt in rookpompen die in militaire oefeningen worden gebruikt. OF.S. Ministerie van Defensie Huidige fotoscpl. Abraham Lopez / 2nd Marine Division / Public Domain. Bron: Wikimedia Commons.
CINC -chloride wordt gebruikt in rookpompen die in militaire oefeningen worden gebruikt. OF.S. Ministerie van Defensie Huidige fotoscpl. Abraham Lopez / 2nd Marine Division / Public Domain. Bron: Wikimedia Commons. - Lasstroomcomponent. In metaalopname. Voor stalen kleurplaten, gegalvaniseerd en ijzeren fineer badkamercomponent met koper.
- In magnesium- en metaalcementcement.
- Om emulsies te doorbreken in het raffineren van olievlekken. Agent in asfaltproductie.
- Elektrolyt in gedroogde batterijen.
 Droge ZnCl -batterij2. Gebruiker: 32bitmaschine; Bewerkt door gebruiker Jaybear/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Droge ZnCl -batterij2. Gebruiker: 32bitmaschine; Bewerkt door gebruiker Jaybear/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. - Vulkanisatie van rubber.
- Dehydraterende agent.
Risico's
Het kan brandwonden veroorzaken in ogen, huid en slijmvliezen.
Wanneer verwarmd tot zijn ontleding stoot giftig waterstofchloride (HCl) en zinkoxide (ZnO) uit.
Waarschuwing voor het gebruik ervan als medicijn
Hoewel overtuigende studies ontbreken, wordt geschat dat als deze verbinding wordt toegediend aan zwangere vrouwen, dit schade kan veroorzaken aan de foetus. Maar potentiële voordelen kunnen meer gewicht hebben dan mogelijke risico's.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Chloride zink. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Liska, m. et al. (2019). Speciaal cement. Zinkoxychloride cement. In Lea's Chemistry of Cement and Concrete (vijfde editie). Hersteld van Scientedirect.
- Pohanish, r.P. (2017). Chloride zink. In Sittig's handboek van giftige en gevaarlijke chemicaliën en carcinagens (zevende editie). Hersteld van Scientedirect.com.
- Gedanken, een. en Perelshtein, ik. (2015). Power echografie voor de productie van nanomaterialen. In Power Ultrasonics. Hersteld van Scientedirect.
- Archibald, s.J. (2003). Overgangsmetaalgroepen 9-12. Reacties en katalyse. Bij het begrijpen van coördinatiechemie II. Hersteld van Scientedirect.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- « Zinkchromaatstructuur, eigenschappen, verkrijgen, gebruik
- Zinknitraatstructuur, eigenschappen, verkrijgen, gebruik »

