Atomische modellen
- 2742
- 736
- Kurt Aufderhar Jr.
 Atomische modellen zijn de verschillende grafische representaties die door de geschiedenis heen aan atomen zijn gegeven. Luiken
Atomische modellen zijn de verschillende grafische representaties die door de geschiedenis heen aan atomen zijn gegeven. Luiken Wat zijn atomaire modellen?
De Atomische modellen Het zijn grafische weergaven van de structuur en de werking van een atoom. Er zijn in de geschiedenis talloze modellen geweest.
Dit komt omdat het idee van het atoom als een fundamenteel blok waarvan de kwestie wordt gemaakt, duizenden jaren geleden werd geboren, in het oude Griekenland. Op dat moment was het atoom slechts een product van filosofische speculatie.
Naarmate nieuwe wetenschappelijke ontdekkingen werden gedaan, werden nieuwe modellen gemaakt om de verworven kennis op te nemen. En dus is het eeuwen na eeuw tot vandaag gebeurd, toen technologie ons in staat heeft gesteld om atomen via microscopen te observeren en het juiste model te bepalen.
Wat zijn atomen?
De atomen zijn submicroscopische structuren waarvan al het onderwerp dat we waarnemen, wordt gevormd en waarmee we elke dag communiceren, van ons eigen lichaam, het voedsel dat we eten, de kleding die we dragen, naar de grote wolkenkrabbers en vliegtuigen.
Ook worden de zon, de maan, de planeten, de sterren en de sterrenstelsels gevormd met atomen.
Deze zijn zo klein dat ze niet kunnen worden gezien met veel voorkomende microscopen. Anderen zijn vereist van meer kracht, ultramicroscopen genoemd. Atomen zijn echter niet de kleinste eenheden van de natuur.
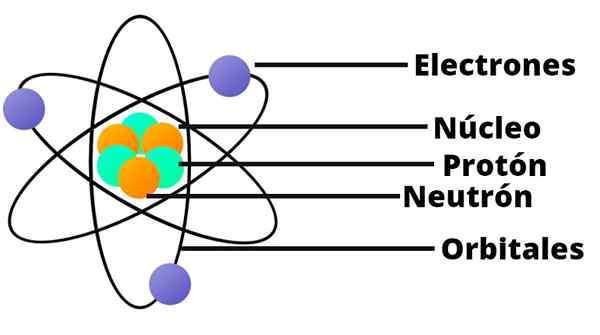
Atomen worden op hun beurt gevormd door nog kleinere deeltjes: protonen, neutronen en elektronen.
Protonen hebben een positieve elektrische lading, terwijl neutronen geen elektrische lading hebben. Deze twee soorten deeltjes vormen de kern van het atoom.
Draaien rond de kernachtige planeten rond de zon zijn elektronen, die een negatieve elektrische lading hebben.
Atoommodel van democritus

Democritus van Abdera was een Griekse filosoof die tussen 460 en 370 leefde vóór het huidige tijdperk. Hij bevestigde dat alle materie werd gevormd door kleine deeltjes die hij atomen noemde, wat in het Grieks ondeelbaar betekent.
Volgens Democritus is het atoom het kleinste deel waarin de zaak kan worden verdeeld. Er is een oneindig aantal, die onverwoestbaar, ongelooflijk, eeuwig en absoluut compact zijn, zonder poriën. Er zijn verschillende soorten, die verschillen per vorm, grootte, positie en de manier waarop ze bereid zijn.
Het kan u van dienst zijn: rampen veroorzaakt door de mens bij het gebruik van wetenschap en technologieDe theorie van Democritus werd verworpen door Aristoteles en vervolgens volledig vergeten tot de opkomst van de moderne wetenschap.
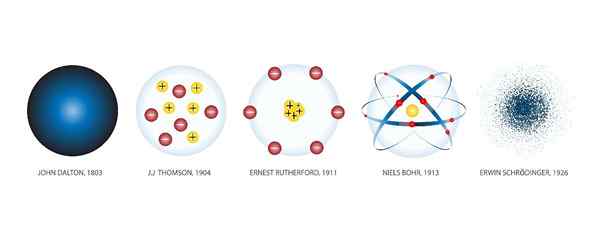
Dalton Atomic Model

John Dalton (1766-1844) was een Engelse meteoroloog die geïnteresseerd was in het onderzoeken van de wetten die gasgedrag regeren. Fruit van zijn werk op dat gebied was het eerste atoommodel van de moderne wetenschap, dat hij in 1803 maakte.
Aangezien het bestaan van protonen en elektronen nog niet was ontdekt, zei Dalton, net als Democritus, dat het atoom het kleinste deel is waarin materie kan worden verdeeld en daarom op zichzelf ondeelbaar is.
Volgens Dalton zijn atomen solide en hebben ze een bolvormige vorm, zoals een honkbalbal. Dalton illustreerde zijn theorie in hout, samen met zijn assistenten, tientallen bollen die atomen van verschillende chemische elementen vertegenwoordigden.
Dit model was van kracht tot de ontdekking van het elektron.
Thomson Atomic Model
De Engelse natuurkundige Joseph John Thomson (1865-1940) moest een van de belangrijkste ontdekkingen van de moderne wetenschap doen: die van het elektron.
Het was in 1897, in het Cavendish Laboratory van de Universiteit van Cambridge, in Engeland, waar een plaquette nog steeds de grote ontdekking herdenkt.
Thompson en zijn assistenten projecteren een kathodestralen op een elektrisch veld. Bij contact met het veld zijn de stralen afgeweken van het vormen van brede hoeken. Dit bevestigde dat kathodestralen een negatieve elektrische lading hadden. Die negatief geladen deeltjes noemden ze elektronen.
Thomson ging ervan uit dat de elektronen in atomen waren ingebed. Zijn atoommodel dateert uit 1904.
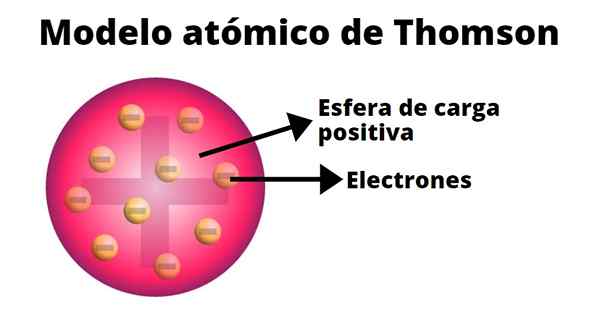
De pudding van rozijnen
In het atoommodel van Thompson is het atoom een vaste sfeer met een positieve belasting (protonen) waarop neutronen (negatieve belasting) willekeurig worden verdeeld, terwijl rozijnen op pudin worden gegooid. Daarom stond dit model bekend als de "Pudin de Pasas".
Volgens Thompson heeft het atoom een straal van 0,00000001 centimeter en is de belasting neutraal, omdat protonen en elektronen dezelfde belasting hebben, maar van tegenovergesteld teken.
Het Thompson -model presenteert geen neutronen.
Rutherford Atomic Model
Ernest Rutherford (1871-1937), een neozylean-natuurkundige, was een van Thomson's meest prominente studenten.
Kan u van dienst zijn: correlationeel onderzoekIn 1911, en gebaseerd op de toen recente ontdekking van radioactiviteit, voerde Rutherford het volgende experiment uit: ze vuurden alfa -radioactieve deeltjes met hoge snelheid en energie tegen een blad van goud.
Als het Thompson Atomic -model correct was, zouden de alfa -deeltjes door het vel gaan zonder af te wijken of met een onbeduidende afwijking. Toen ze echter de afwijkingshoek van de deeltjes berekenden, ontdekten ze dat het breed was en dat sommigen zelfs tegen het gouden blad stuiterden.
Met dit resultaat begreep Rutherford dat het atoom een zeer kleine en zeer gecondenseerde kern zou moeten hebben. Deze kern was positief geladen.
Een klein zonnestelsel
Het atoommodel van Rutherford is als een miniatuur zonnestelsel. In het midden, op de plaats die zou overeenkomen met de zon, is er de kern met zijn positief geladen protonen. Rond dit, rond een baan om als planeten, zijn er willekeurig verdeelde elektronen.
Rutherford heeft ook vastgesteld dat de massa van het atoom gelijk is aan de som van het elektronen- en protonenmassa.
Bohr Atomic Model
Hoewel het Rutherford -model een onmiskenbare vooruitgang was met betrekking tot eerdere modellen, had het belangrijke defecten. Als de elektronen bijvoorbeeld effectief orbitaal rond de kern zijn, verliezen ze uiteindelijk energie en stort ze in op de kern. Maar dit is duidelijk niet gebeurd.
Het was de Deense natuurkundige Niels Bohr (1885-1962), een student van Rutherford aan de Universiteit van Manchester (Engeland), die in 1913 een atoommodel zou voorstellen dat de problemen van zijn oude professor oploste.
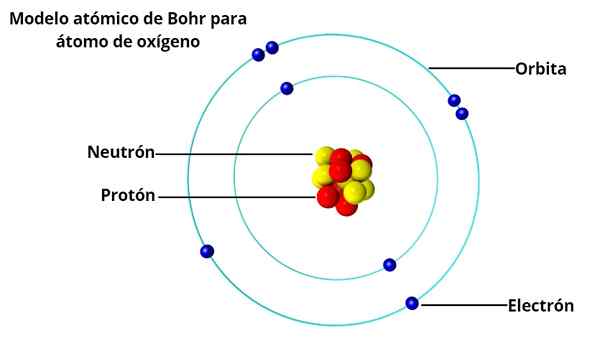
Cirkelvormige banen
In het atoommodel van Bohr draaien elektronen niet vrij rond de kern, maar doen dit in stabiele cirkelvormige banen, van elkaar gescheiden op een bepaalde afstand, vergelijkbaar met hoe de planeten van het zonnestelsel zijn gerangschikt gerangschikt. Elke baan wordt het energie- of energieniveau genoemd.
Op basis van het onderzoek van Max Planck en Albert Einstein, bepaalde hij dat elk elektron in zijn baan een bepaalde hoeveelheid energie heeft.
Terwijl ze stabiel rond de kern rond de kern zijn, wordt gezegd dat elektronen zich in stationaire toestand bevinden. Aan de andere kant, wanneer een elektron "springt" naar een lagere energiebaan, is er een foton.
Kan u van dienst zijn: methodologieHet Bohr -model was echter niet succesvol om de werking van atomen met meer dan één elektron uit te leggen.
Sommend Atomic Model
Arnold Sommerfeld (1868-1951) was een Duitse natuurkundige die zijn werk wijdde aan het uitbreiden van het atoommodel van Bohr. Dit uitgebreide model werd gepresenteerd in 1916.
Gebaseerd op de relativiteitstheorie van Einstein, ontdekte Sommerfeld dat sommige elektronen rond de kern rond de snelheden in de buurt van licht draaien (300.000 kilometer per seconde).
Hij bracht ook de volgende aanpassingen aan het Bohr -model:
- De elektronen bewegen rond de kern in cirkelvormige en elliptische banen. Bohr herkende alleen cirkelvormige banen.
- Binnen hetzelfde energieniveau zijn er subniveaus met enigszins verschillende energieën.
Kwantummechanisch model (Broglie, Heisenberg en Schrödinger)
Dit is het meest nauwkeurige atoommodel dat bekend is en momenteel wordt geaccepteerd, met enkele daaropvolgende toevoegingen. Het werd ontwikkeld door drie wetenschappers: de Duitse Werner Heisenberg (1901-1976), de Oostenrijkse Erwin Schrödinger (1887-1961) en de Fransman Louis de Broglie (1892-1987).
Dit model gooit het idee weg van elektronen die de kern draaien. In plaats daarvan hebben we elektronische wolken, die ruimtes zijn rond de kern waarin het mogelijk is om een elektron te vinden. Dit gedraagt zich als een stationaire golf.
De kans om te vinden wordt berekend met een vergelijking die is vastgesteld door Schrödinger.
Dit is het kwantummechanische model van het atoom dat is gestart vanuit de Schrödinger -vergelijking. Met deze vergelijking zou u de kans kunnen kennen om een elektron op een bepaald punt van een atoom te vinden.
In dit model beweegt elk elektron in een specifieke richting, die wordt bepaald door vier kwantumaantallen, wat: hoofdkwantumnummer, secundair kwantumnummer, magnetisch kwantumnummer en kwantumnummer spin.
Er zijn geen twee elektronen die identieke kwantumaantallen bezitten, zoals vermeld door het uitsluitingsprincipe ontdekt door natuurkundige Wolfgang Pauli.
Referenties
- (2010). Atoom. Modern Encyclopedia Brits.
- (S. F.)). Democritus atomisch model, filosofisch atomisme. Uit energie-nucleair genomen.netto.
- (S. F.)). Sommerfeld Atomic Model, uitbreiding naar het Bohr -model. Uit energie-nucleair genomen.netto.
- Bertsch, G. F.; Trefil, James en McGrayne, Sharon Bertsch (2021). Atoom. Britannica Encyclopedia. Uitgebracht uit Britannica.com.
- Duignan, B. (2021). Democritus. Britannica Encyclopedia. Uitgebracht uit Britannica.com.
- Nieuwe wereld Encyclopedia -bijdragers. (2021). Atoom. Ontleend aan Newworldyclopedia.borg.
- Zita, Ana. (S. F.)). Atomische modellen. Uit Todamateria genomen.com.

