Zoutzuur (HCL)

- 2165
- 151
- Ernesto McKenzie
 Container met zoutzuur. Luiken
Container met zoutzuur. Luiken Wat is zoutzuur?
Hij zoutzuur (HCl), of muriatinezuur, is een anorganische verbinding die wordt gevormd door de oplossing in waterstofchloride water, waardoor het hydroniumion wordt veroorzaakt (h3OF+) en het chloride -ion (Cl-)). Meer specifiek is het de hydratie van het chloorhalogeen met waterstof.
HCL is een sterk zuur dat volledig is geïoniseerd in water en zijn ionisatieproducten zijn stabiel. De volledige HCl -ionisatie wordt bevestigd door het feit dat de pH van een 0,1 M HCl -oplossing 1 is.
De belangrijkste methode voor de industriële HCL -productie is de chlorering van organische verbindingen om bijvoorbeeld dichloormethaan, trichloorethyleen, perclorethyleen of vinylchloride te produceren. HCL is een bijproduct van de chlorinatiereactie.
Het wordt gebruikt in basisgraden in talloze chemische reacties, bij de chemische digestie van organische verbindingen, enz.
Zoutzuurdampen (waterstofchloride) kunnen ernstige ooglaesies veroorzaken. Ze kunnen ook irritatie en ernstige problemen veroorzaken in de luchtwegen.
Maaglicht heeft een zure pH (1-3) met een hoge HCL-concentratie. De zure aanwezigheid bevordert sterilisatie van maaggehalte, inactiveren van talloze bacteriën die aanwezig zijn in voedsel. Dit zou de gastro -enteritis verklaren die geassocieerd is met de toestand van acroerhydria.
Bovendien vergemakkelijkt de HCL de digestie van eiwitten door het enzympepsine van proteolytische werking te activeren.
Het wordt gebruikt bij het reinigen van de zwembaden, een gemeenschappelijk wasmiddel is meestal voldoende, maar er zijn vlekken die zich tussen de tegels hechten, waarbij in deze gevallen het gebruik van zoutzuur vereisen.
Het wordt gebruikt bij pH -controle in farmaceutische producten, voedsel en drinkwater. Het wordt ook gebruikt bij de neutralisatie van afvalstromen die alkalisch materiaal bevatten.
Het zoutzuur wordt gebruikt bij de regeneratie van ionenuitwisselingen, gebruikt om metalen ionen of andere soorten ionen in de industrie te ontvoeren, in onderzoekslaboratoria en zuivering van drinkwater.
Aan de andere kant kan ook worden opgemerkt dat waterstofchloride, gasvormige verbinding, een diatomisch molecuul is en de atomen die het vormen, worden verbonden door een covalente binding. Ondertussen is het cloohydrinezuur een ionische verbinding die in waterige oplossing is gedissocieerd in H+ en Cl-. De interactie tussen deze ionen is elektrostatisch.
Chemische structuur van zoutzuur
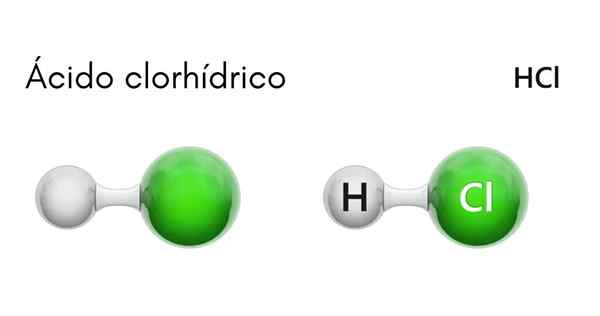
Elk HCl -molecuul wordt gevormd door een waterstofatoom en een andere chloor. Hoewel bij kamertemperatuur de HCl giftig is en een kleurloos gas, indien opgelost in water, treedt zoutzuur op.
Zoutzuurvorming
-Het kan worden geproduceerd door NaCl -elektrolyse (natriumchloride) die h veroorzaakt2 (G), Cl2 (G), 2e (AC) en OH- (AC). Dan:
H2 + Klet2 => 2 HCl
Dit is een exotherme reactie.
-HCl treedt op door natriumchloride te reageren met zwavelzuur. Proces dat als volgt kan worden gepresteerd:
NaCl +H2SW4 => Nahso4 + HCl
Kan u van dienst zijn: zure zouten (oxisalen)Vervolgens wordt waterstofchloride verzameld en wordt natriumchloride met natriumbisulfiet volgens de volgende reactie gereageerd:
NaCl +Nahso4 => NA2SW4 + HCl
Deze reactie werd geïntroduceerd door Johan Glauber in de zeventiende eeuw om zoutzuur te produceren. Het wordt momenteel gebruikt in laboratoria, omdat het belang van het industriële gebruik ervan is afgenomen.
-Zoutzuur kan worden geproduceerd als een bijproduct van chlorering van organische verbindingen, zoals: bij de productie van dichloormethaan.
C2H4 + Klet2 => C2H4Klet2
C2H4Klet2 => C2H3Cl +hcl
Deze methode voor het produceren van HCL wordt meer industrieel gebruikt, waardoor 90% van de HCL in de Verenigde Staten wordt berekend.
-En ten slotte komt HCL voor bij de verbranding van gechloreerd organisch afval:
C4H6Klet2 + 5 o2 => 4 CO2 + 2 H2O +2 HCl
Waar is zoutzuur?
Het zoutzuur is geconcentreerd in het maaglicht waar een pH van 1 wordt bereikt. Het bestaan van een slijmbarrière, rijk aan bicarbonaat, voorkomt dat maagcellen schade lijden als gevolg van de lage maag -pH.
Er zijn drie belangrijkste fysiologische stimuli voor de secretie van h+ Door de pariëtale cellen van het maaglichaam: maag, histamine en acetylcholine.
Maag
Gastrine is een hormoon dat wordt uitgescheiden in de regio van de maagclub die handelt door de intracellulaire concentratie van CA te vergroten, een tussenliggende medediair van de activering van het actieve transport van H+ Naar het maaglicht.
Actief transport wordt gemaakt door een Atpay -enzym dat de energie in de ATP gebruikt om H te dragen+ naar het maaglicht en introduceren k+.
Histamine
Het wordt uitgescheiden door de zo -called cellen vergelijkbaar met de enterocromofines (SEC) van het maaglichaam. De werking ervan wordt gemedieerd door een toename van de concentratie van cyclische versterker en werkt door te vergroten, evenals maag, actief transport van H+ Naar het maaglicht gemedieerd door een H -pomp+-K+.
Acetylcholine
Het wordt uitgescheiden door de vagale zenuwaansluitingen, evenals de gemiddelde maag zijn werking voor een toename van de intracellulaire CA, waardoor de werking van de H -pomp wordt geactiveerd+-K+.
De H+ van pariëtale cellen komt uit de reactie van de CO2 met h2Of om h te vormen2CO3 (koolzuur). Dit wordt vervolgens opgesplitst in h+ en HCO3-. De H+ Het wordt actief naar maaglicht getransporteerd door het maag -apicale membraan. Ondertussen, de HCO3- Het wordt gebracht naar het bloed gekoppeld aan de binnenkomst van CL-.
Het coupmechanisme tegenovertransport of antitransport coup-HCO3- die voorkomt in het basale membraan van pariëtale cellen produceert de intracellulaire accumulatie van CL-. Vervolgens gaat het ion naar maaglicht bij h+. Naar schatting heeft de maagsecretie van HCL een concentratie van 0,15 m.
Andere biologische HCL -bronnen
Er zijn andere stimuli voor HCL -secretie door pariëtale cellen, zoals cafeïne en alcohol.
Maag- en duodenale zweer treedt op wanneer de barrière wordt onderbroken die de maagcellen beschermt tegen HCL's schadelijke werking.
Kan u van dienst zijn: zinksulfide (ZnS)Door de bovengenoemde beschermende werking te elimineren, bacteriën Helicobacter Pilori, Acetylsalicylzuur en niet -steroïde ontstekingsremmeringen (NSAID's) dragen bij aan de productie van zweren.
Zure secretie heeft als functie de eliminatie van microben die aanwezig zijn in voedsel en initiëren eiwitvertering, door de werking van pepsine. De hoofdcellen van het maaglichaamsgeheim.
Fysische en chemische eigenschappen van zoutzuur
Molecuulgewicht
36,458 g/mol.
Kleur
Het is een kleurloze of licht geelachtige vloeistof.
Geur
Het is een irritante hectare geur.
Smaak
De drempel voor het proeven in zuiver water is een concentratie van 1,3 x 10-4 mol/l.
Kookpunt
-121º F A 760 mmHg. -85.05º C bij 760 mmHg.
Smeltpunt
-174º F (-13.7 º F) voor een HCl -oplossing van 39,7% P/P in water), -114,22º C.
Oplosbaarheid in water
De HCL -oplossing kan 67% P/P A 86º F hebben; 82.3 g/100 g water bij 0ºC; 67,3 g/100 g water bij 30 ° C en 63,3 g/100 g water bij 40 ° C.
Oplosbaarheid van methanol
51.3 g/100 g oplossing bij 0º C en 47 g/100 oplossing bij 20 ° C
Ethanol -oplosbaarheid
41.0 /100 g oplossing bij 20º C
Ether -oplosbaarheid
24,9 g/100 oplossing bij 20º C.
Dikte
1,059 g/ml bij 59º F in een oplossing van 10,17 % P/P.
Gasdichtheid
1.00045 g/l
Stoomdichtheid
1.268 (in luchtrelatie genomen als 1)
Dampdruk
32.452 mmHg bij 70ª F; 760 mmHg bij -120,6 º F
Stabiliteit
Heeft een hoge thermische stabiliteit.
Zelfrichting
Het is niet ontvlambaar.
Ontleding
Het ontleedt door te verwarmen door een giftige chloorrook uit te zenden.
Viscositeit: 0,405 cpoise (vloeistof bij 118,6 º K), 0,0131 cpoise (stoom bij 273,06 º K).
Corrosiviteit
Het is zeer corrosief voor aluminium, koper en roestvrij staal. Het valt alle metalen aan (kwik, goud, platina, zilver, tantalio, behalve voor bepaalde legeringen).
Oppervlaktespanning
23 mn/cm bij 118,6º K.
Polymerisatie
Aldehyden en epoxiden ervaren een gewelddadige polymerisatie in aanwezigheid van zoutzuurzuur.
Fysische eigenschappen, zoals viscositeit, stoomdruk, kookpunt en smeltpunt worden beïnvloed door de procentuele concentratie voor HCl.
Gebruik van zoutzuur
Het zoutzuur heeft thuis talloze toepassingen in verschillende industrieën, in lesgeven en onderzoekslaboratoria, enz.
Industrieel en thuis
-Zuurzuur wordt gebruikt in hydrometallurgische verwerking, bijvoorbeeld bij de productie van aluminiumoxide en titaniumdioxide. Het wordt gebruikt bij de activering van de productie van oliebronnen.
Zure injectie verhoogt de porositeit rond olie, waardoor de extractie de voorkeur heeft.
-Het wordt gebruikt voor de eliminatie van caco -afzettingen3 (Calciumcarbonaat) door transformatie in cocl2 (calciumchloride), dat meer oplosbaar is en gemakkelijk te elimineren is. Evenzo wordt het industrieel gebruikt bij de verwerking van staal, materiaal met tal van toepassingen en toepassingen zowel in industrieën als in constructies en thuis.
-Massa's gebruiken HCL -oplossingen voor het wassen en schoonmaken van bakstenen. Het wordt thuis gebruikt in het werk van het reinigen en desinfectie van de badkamers en hun afvoeren. Bovendien wordt zoutzuur gebruikt in gravures, inclusief metaalreinigingsbewerkingen.
Kan u van dienst zijn: thermisch: structuur, kenmerken, formatie, voorbeelden-Het zoutzuur wordt aangebracht bij de eliminatie van het Mohoso -ijzeroxide Lay.
Vertrouwen2OF3 + Fe +6 HCl => 3 Fecl2 + H2OF
-Ondanks dat het zeer corrosief is, wordt het gebruikt om metalen vlekken in ijzer, koper en messing te verwijderen, met behulp van een 1:10 verdunning in water.
Synthese en chemische reacties
-Het zoutzuur wordt gebruikt in basistitratie of alkalisreacties, evenals in de oplossing van de oplossing pH. Bovendien wordt het gebruikt in tal van chemische reacties, bijvoorbeeld bij de eiwitvertering, een procedure voorafgaand aan onderzoek naar aminozuurgehalte en identificatie.
-Een belangrijk gebruik van zoutzuur is de productie van organische verbindingen, zoals vinylchloride en dichloormethaan. Zuur is een intermediair bij de productie van polycarbonaten, geactiveerd koolstof en ascorbinezuur.
-Het wordt gebruikt in Pegas -fabrikanten. Terwijl het in de textielindustrie wordt gebruikt bij het bleken van stof. Het wordt gebruikt in de lederen zonnebankindustrie die tussenbeide komt in zijn verwerking. Het vindt ook gebruik als meststof en bij de productie van chloride, kleurstoffen, enz. Het wordt ook gebruikt in galvanoplastiek, in fotografie en in de rubberindustrie.
-Het wordt gebruikt bij de productie van kunstmatige zijde, bij het verfijnen van oliën, vetten en zeep. Bovendien wordt het gebruikt in polymerisatie-, isomerisatie- en alkylatiereacties.
Risico's en toxiciteit van zoutzuur
Het heeft corrosieve werking op de huid en slijmvliezen die brandwonden produceren. Deze kunnen, indien ernstig, ulceraties produceren die keloïde en intrekbare littekens achterlaten. Oogcontact kan totale vermindering of verlies van het gezichtsvermogen veroorzaken als gevolg van hoornvliesschade.
Wanneer het zuur het gezicht bereikt, kan ernstige littekens veroorzaken die het gezicht misvormen. Frequent contact met zuur kan ook dermatitis veroorzaken.
De inname van zoutzuur veroorzaakt verbranding van de mond, keel, slokdarm en maagdarmkanaal, waardoor misselijkheid, braken en diarree veroorzaakt. In extreme gevallen kan de perforatie van de slokdarm en darm optreden, met hartstilstand en dood.
Aan de andere kant kunnen zure dampen, afhankelijk van hun concentratie, een irritatie van de luchtwegen veroorzaken, waardoor faryngitis, glottis oedeem, vernauwing van bronchi met bronchitis, cyanose en longoedeem (overmatige accumulatie van vloeistof in de longen) en in extreme veroorzaken, en in extreme veroorzaken gevallen, dood.
Blootstelling aan hoge niveaus van dampen van zoutzuur kan zwelling en keelkrampen veroorzaken met de daaruit voortvloeiende verstikking.
Tentheelkundige necrose die zich in de tanden manifesteren, komen ook vaak voor bij het verlies van hun helderheid; Ze worden geelachtig en zacht en breken uiteindelijk.
Referenties
- Studiousguy. (2018). Zoutzuur (HCL): belangrijk gebruik en toepassingen. Uitgevoerd uit: StudiousGuy.com
- Ganong, W. F. (2003). Overzicht van medische fysiologie. Eenentwintig editie. De McGraw-Hill Companies Inc.
- CTR. Hydrochloorzuurveiligheidsblad. [PDF]. Genomen van: uacj.mx

