Sommerfeld atomaire modelkenmerken, postulaten, voor- en nadelen
- 2109
- 225
- Nathan Wiegand
Hij Sommend Atomic Model Het werd gecreëerd door de Duitse natuurkundige Arnold Sommerfeld tussen 1915 en 1916, om de feiten uit te leggen die het Bohr -model, kort daarvoor in 1913, niet bevredigend kon uitleggen. Sommerfeld presenteerde zijn resultaten eerst aan de Bavaria Academy of Sciences en publiceerde ze vervolgens in Annalen der Physik Magazine.
Het atoommodel voorgesteld door de Deense fysicus Niels Bohr beschrijft.
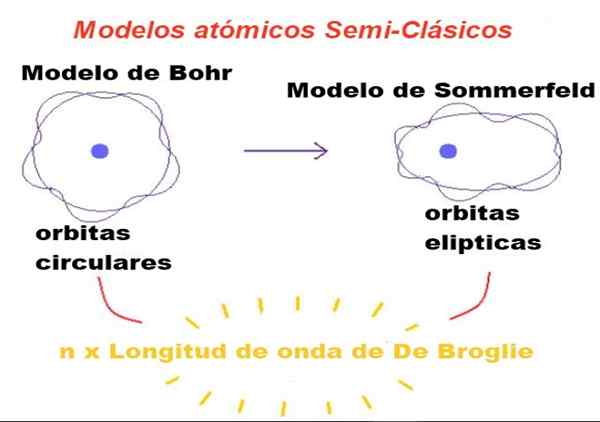
 Figuur 1. In semi-klassieke modellen zijn banen Newtoniaans, maar alleen degenen wiens perimeter een gehele getal is van de Broglie-golflengte is toegestaan. Bron: f. Zapata.
Figuur 1. In semi-klassieke modellen zijn banen Newtoniaans, maar alleen degenen wiens perimeter een gehele getal is van de Broglie-golflengte is toegestaan. Bron: f. Zapata. In de door Bohr voorgestelde theorie kan het elektron dat rond de kern draait, alleen bepaalde waarden van zijn orbitale hoekmoment hebben, en daarom kan het niet in een baan zijn.
Bohr was ook van mening dat deze banen cirkelvormig waren en een enkel kwantumnummer genoemd Hoofdkwantumnummer n = 1, 2, 3 ... geserveerd om de toegestane banen te identificeren.
De eerste modificatie die door Sommerfeld in het Bohr -model werd geïntroduceerd, bestond uit aan te nemen dat de elektronenbaan ook elliptisch kan zijn.
Een omtrek wordt beschreven door zijn straal, maar voor een ellips moet je twee parameters geven: semi -senije en kleine half -semi, naast de ruimtelijke oriëntatie van hetzelfde. Hiermee introduceerde hij nog twee kwantumnummers.
De tweede hoofdaanpassing die Sommerfeld heeft aangebracht, was om relativistische effecten toe te voegen aan het atoommodel. Er is niets sneller dan het licht, maar Sommerfeld had elektronen gevonden met aanzienlijk nauwe snelheden, daarom was het noodzakelijk om de relativistische effecten op te nemen in elke beschrijving van de atoom.
[TOC]
Postulaten van het Sommerfeld Atomic Model
Elektronen volgen cirkelvormige en elliptische banen
Elektronen in de atoom volgen elliptische baan (cirkelvormige banen zijn een bepaald geval) en hun energiestatus kan worden gekenmerkt door 3 kwantumnummers: het belangrijkste kwantumnummer N, Het secundaire kwantumnummer of azimutale nummer l en het magnetische kwantumnummer ML.
Kan u van dienst zijn: binaire zoutenIn tegenstelling tot de omtrek heeft een ellips een grotere semije en een kleine helft.
Maar ellipsen met dezelfde grote semi -as kunnen ze verschillende kleine helft -semi hebben, afhankelijk van de mate van excentriciteit. Een excentriciteit gelijk aan 0 komt overeen met een cirkel, dus het sluit circulaire trajecten niet uit. Bovendien kunnen ellipsen in ruimte verschillende neigingen hebben.
Dat is de reden waarom Sommerfeld aan zijn model het secundaire kwantumnummer L heeft toegevoegd om de kleine helft en het magnetische kwantumnummer M aan te gevenL. Zo wees hij erop wat de toegestane ruimtelijke oriëntaties van de elliptische baan zijn.
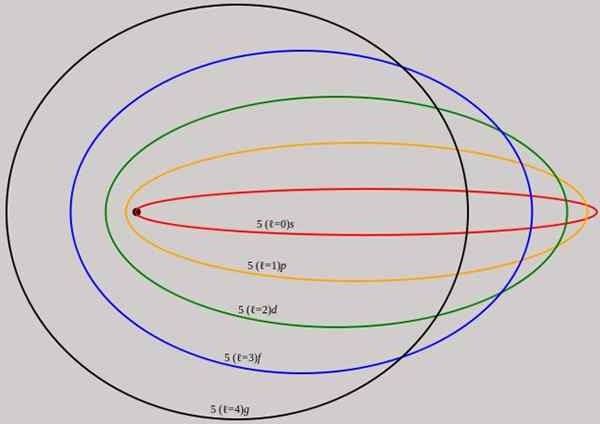 Figuur 2. De banen die overeenkomen met het energieniveau n = 5 worden getoond voor verschillende hoekmomentum L die volledige golflengten van de Broglie hebben. Bron: Wikimedia Commons.
Figuur 2. De banen die overeenkomen met het energieniveau n = 5 worden getoond voor verschillende hoekmomentum L die volledige golflengten van de Broglie hebben. Bron: Wikimedia Commons. Merk op dat het geen nieuwe hoofdkwantumnummers toevoegt, dus de totale energie van het elektron in elliptische baan is hetzelfde als in het Bohr -model. Daarom zijn er geen nieuwe niveaus van energie, maar een ontvouwing van de niveaus gegeven door nummer N.
Zeeman -effect en grimmig effect
Op deze manier is het mogelijk om een bepaalde baan volledig op te geven, dankzij de 3 genoemde kwantumnummers en dus het bestaan van twee effecten uit te leggen: het Zeeman -effect en het grimmige effect.
En verklaart dus de ontplooiing van energie die in het normale zeeman -effect verschijnt (er is ook een afwijkend Zeeman -effect), waarin een spectrale lijn is verdeeld in verschillende componenten wanneer deze in aanwezigheid van een magnetisch veld is.
Deze ontplooiing van de lijnen vindt ook plaats in aanwezigheid van een elektrisch veld, dat bekend staat als Stark -effect, waardoor Sommerfeld nadenkt over de aanpassing van het Bohr -model om deze effecten te verklaren.
De atoomkern en elektronen bewegen zich rond zijn massacentrum
Nadat Ernest Rutherford de atomaire kern ontdekte en dat het feit dat bijna de hele massa van het atoom daar is geconcentreerd, geloofden wetenschappers dat de kern min of meer stationair was.
Het kan u van dienst zijn: lithiumhydroxide (liOH)Sommerfeld stelde echter dat zowel de kern als de elektronen in een baan rond het massacentrum van het systeem bewegen, dat natuurlijk heel dicht bij de kern ligt. Het model maakt gebruik van de verminderde massa van het elektronen -kernsysteem, in plaats van de elektronenmassa.
In elliptische banen, net als bij de planeten rond de zon, zijn er momenten waarop het elektron dichterbij is en in anderen verder van de kern. Daarom is de snelheid op elk punt van zijn baan anders.
 figuur 3.- Arnold Sommerfeld. Bron: Wikimedia Commons. Gfhund [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)].
figuur 3.- Arnold Sommerfeld. Bron: Wikimedia Commons. Gfhund [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Elektronen kunnen relativistische snelheden bereiken
Sommerfeld introduceerde in zijn model de constante van de fijne structuur, een constante zonder dimensies gerelateerd aan elektromagnetische kracht:
α = 1/137.0359895
Het wordt gedefinieerd als het quotiënt tussen de elektronenbelasting En Ik vierkant hoog, en het product tussen de constante van Planck H en de snelheid van het licht C In een vacuüm, allemaal vermenigvuldigd met 2π:
α = 2π (E2/H.c) = 1/137.0359895
De fijne structuurconstante relateert drie van de belangrijkste constanten van atomaire fysica. De andere is de massa van het elektron, dat hier niet verschijnt.
Op deze manier is het gekoppeld aan de elektronen met de fotonen (die op snelheid C in de leegte bewegen), en legt het zo de afwijkingen van enkele spectrale lijnen van het waterstofatoom van de voorspellingen door het Bohr -model uit.
Dankzij relativistische correcties, energieniveaus met gelijk N Maar anders l Ze scheiden en geven aanleiding tot de fijne structuurstructuur, van daaruit de naam van de constante α.
En alle karakteristieke lengtes van het atoom kunnen worden uitgedrukt in termen van deze constante.
 Figuur 4. De kwantisatie van hoekmomentum L wordt getoond. In tegenstelling tot cirkelvormige banen, elliptisch. Bron: f. Zapata.
Figuur 4. De kwantisatie van hoekmomentum L wordt getoond. In tegenstelling tot cirkelvormige banen, elliptisch. Bron: f. Zapata. Voor-en nadelen
Voordelen
-Sommerfeld toonde aan dat een enkel kwantumnummer onvoldoende was om de spectrale lijnen van de waterstofatoom te verklaren.
-Het was het eerste model dat een ruimtelijke kwantisatie voorstelde, omdat de projecties van de banen in de richting van het elektromagnetische veld in feite zijn gekwantiseerd.
Kan u van dienst zijn: Plasma Status: kenmerken, typen en voorbeelden-Het Sommerfeld -model legde naar tevredenheid uit dat elektronen met hetzelfde belangrijkste kwantumnummer N verschillen in hun energietoestand, omdat ze verschillende kwantumaantallen L en M kunnen hebbenL.
-Geïntroduceerd de constante α om de fijne structuur van het atoomspectrum te ontwikkelen en het Zeeman -effect te verklaren.
-Het omvatte de relativistische effecten, omdat elektronen kunnen bewegen met snelheden die vrij dicht bij die van het licht kunnen worden.
Nadelen
-Zijn model was alleen van toepassing op atomen met een elektron en in veel opzichten op de atomen van alkalische metalen zoals Li2+, Maar het is niet nuttig in het heliumatoom, dat twee elektronen heeft.
-Verklaarde de elektronische verdeling niet in het atoom.
-Het model mocht de energieën van de toegestane toestanden en de frequenties van de uitgegeven of geabsorbeerde straling berekenen in de overgangen tussen staten, zonder informatie te geven over de tijden van deze overgangen.
-Nu is het bekend dat elektronen geen trajecten volgen met vooraf bepaalde vormen als banen, maar dat ze bezetten Orbitalen, Ruimtegio's die overeenkomen met oplossingen van Schrodinger -vergelijking.
-Het model combineerde klassieke aspecten willekeurig met kwantumaspecten.
-Hij slaagde er niet in om een afwijkend Zeeman -effect uit te leggen, want dit is nodig door het Dirac -model, dat later een ander kwantumnummer heeft toegevoegd.
Interessante artikelen
Schrödinger atomair model.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Leucipo -atoommodel.
Bohr Atomic Model.
Huidig atoommodel.
Referenties
- Brainekart. Sommerfeld Atom -model en zijn nadelen. Hersteld van: Brainkart.com.
- Hoe we de Cosmos hebben leren kennen: licht en materie. Het atoom van Sommerfeld. Opgehaald uit: Tastargarden.co.Uk
- Parker, p. Het bohr-sommerfeld atoom. Hersteld van: physnet.borg
- Educatieve hoek. Sommerfeld -model. Hersteld van: Rinconucatief.com.
- Wikipedia. Sommend Atomic Model. Hersteld van: is.Wikipedia, org.
- « Wat zijn de natuurlijke componenten van de aarde?
- Algemene formule kwadratische vergelijkingen, voorbeelden, oefeningen »

