Myosine -kenmerken, structuur, typen en functie
- 2572
- 337
- Glen Armstrong
De Myosine Het is een moleculaire motor, van eiwitkarakter, in staat om op actinefilamenten in de cytosol te bewegen. De energie die de verplaatsing van myosine drijft, komt van ATP -hydrolyse. Daarom wordt myosine meestal gedefinieerd als een mecanochemie -enzym.
In eukaryoten is myosine een zeer overvloedig eiwit. Er zijn verschillende soorten myosine, die worden gecodeerd door een familie van genen. In gisten worden 5 klassen onderscheiden, terwijl tientallen zijn beschreven bij zoogdieren.
 Bron: David Richfield (gebruiker: Slashme) Bij gebruik van deze afbeelding in externe werken kan het als volgt worden aangehaald: Richfield, David (2014). "Medical Gallery of David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]
Bron: David Richfield (gebruiker: Slashme) Bij gebruik van deze afbeelding in externe werken kan het als volgt worden aangehaald: Richfield, David (2014). "Medical Gallery of David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]] Myosine heeft een breed scala aan functies. Myosin I, naast Actin, neemt deel aan de beweging van keratocyten.
Myosin II biedt stijfheid aan het plasmamembraan, neemt deel aan cytokinese en spiercontractie. Zowel Myosinas I als II werken samen met celmigratie. Myosinas I en V voeren het transport van blaasjes langs actinefilamenten uit.
[TOC]
Structuur
In elektronische microfoto's heeft de typische myosine -isovormstructuur drie domeinen: hoofd, nek en staart. Door hydrolyse met chimotripsine, een segment bestaande uit hoofd en nek, zware meromiosine (HMM) en een staartsegment, wordt lichte meromiosine (LMM) verkregen.
De beheersing van het hoofd is het N-terminale uiteinde van de zware keten en het domein van de staart is het C-terminale uiteinde van de lichte keten.
Myosineklassen kunnen worden onderscheiden door het aantal polypeptische ketens dat het samenstelt, en de overvloed en lichte ketenklasse verenigd rond.
Myosine I heeft een polypeptideketen, die een kop vormt en zijn staart mist alfa helicidale gebieden. Terwijl myosinas I en V twee polypeptideketens hebben, en daar.
Myosinas I en V hebben vakbondssites voor calmodulin, die CA reguleert en repareert+2, In lichte ketens. De myosina die ik heb opgelost CA+2 In lichte ketens, maar het doet dit anders dan calmoduline.
Kenmerken
Op mechanisch niveau hebben myosinas drie kenmerken, namelijk:
- Het hoofd van myosine is het motordomein dat door discrete stappen gaat: de vereniging van myosin gaat naar een actinefilament, de neiging ervan en de daaropvolgende scheiding produceren de beweging van myosine. Dit proces is cyclisch en hangt af van ATP.
- Conformatieveranderingen: de hydrolyse van een ATP -molecuul wordt gekoppeld aan elke stap van een myosinemolecuul, door middel van versterking en transmissieniveaus. Dit impliceert grote conformationele veranderingen van myosine.
Kan u van dienst zijn: radiale symmetrieHet eerste niveau van versterking wordt geproduceerd door het verlies van de gamma-fosfaatgroep van de ATP, die een reorganisatie van de structurele elementen op de ATP Union-site mogelijk maakt. Deze reorganisatie wordt gecoördineerd met structurele veranderingen in de site van Union in Actin.
Het tweede niveau van versterking impliceert de communicatie van conformationele verandering in de actieve site naar structurele componenten van het terminale carboxyl.
- Directionaliteit: het is vastgesteld dat de mijne een polariteit of omgekeerde directionaliteit heeft, tegen het einde (+) van de actinefilament. Deze conclusie komt van de nivelleringsexperimenten van de actinefilament, met behulp van fluorescentie -optische microscoop.
Functie
Myosine, naast actine, neemt deel aan spiercontractie, cellulaire adhesie, cytokinese, die stijfheid verlenen aan corticale membranen en de verplaatsing van sommige blaasjes, naast andere functies.
Myosine -defecten kunnen pathologische aandoeningen veroorzaken. Defecten in myosinas I en V zijn bijvoorbeeld respectievelijk verwant met myopathieën van myosine en pigmentstoornissen (Griselli -syndroom). Terwijl de aandoeningen in myosine -isovormen VI verlies van het oor veroorzaken.
Spiercontractie
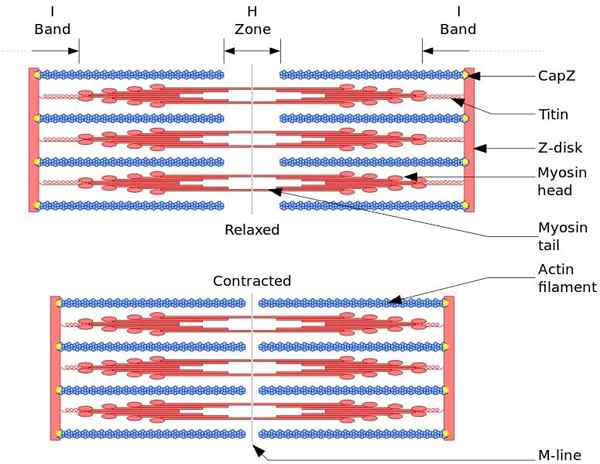
De functionele en structurele eenheid van skeletspier is sarcomro. Tijdens spiercontractie bereikt de lengte van de sarcomer 30% van de oorspronkelijke lengte.
Sarcomeren bestaan uit dikke, myosine en dunne filamenten van actine, die op een complexe manier zijn georganiseerd. Over het algemeen bevinden myosinekoppen zich aan de distale uiteinden van de gloeidraad en zijn staart naar het midden van de sarcomero, en de organisatie is bipolair.
Om spiercontractie te maken, moeten myosinekoppen van de tegenoverliggende uiteinden naar de z -schijf of het uiteinde (+) van de gloeidraad gaan. Omdat de organisatie van dikke filamenten bipolair is, treedt het glijden van dunne filamenten op dikke filamenten op, aangedreven door ATP.
De verplaatsingskracht treedt op omdat honderden myosinekoppen, van een dikke gloeidraad, interageren met een dunne gloeidraad.
Cytocinese
Tijdens de mitose, wanneer de microtubuli van de spindelpalen worden gescheiden, vormen actine en myosine II een contractiele ring in de cel van de cel. Deze ring samentrekt zijn diameter en verdeelt de cel in twee delen.
Het verlenen van stijfheid aan corticale membranen
In mutante cellen die myosine II missen, wordt het plasmamembraan gemakkelijk vervormd wanneer een externe kracht wordt uitgeoefend. Dit gebeurt omdat myosine II aggregatiekracht biedt aan de plasmamembraaneiwitten.
Kan u van dienst zijn: morfologische aanpassingCellulaire hechting
In het epitheliale weefsel bevinden de contractiele actine- en myosine II -stralen zich in de buurten van het plasmamembraan en vormen een cirkelvormige riem die het cellulaire celoppervlak omringt. Deze cirkelvormige riem bepaalt de vorm van de cel en handhaaft de vereniging tussen de cellen.
Het contact tussen cellen vindt plaats door de cirkelvormige riemunie tot celadhesiemoleculen, met behulp van bindende eiwitten.
Verplaatsing van sommige blaasjes
Experimenteel bewijs blijkt dat myosine V membraantransport uitvoert van het Golgi -apparaat naar de periferie van de cel. Sommige bewijzen zijn:
- In nerveuze weefselcellen, door immunofluorescentie van astrocyten, werd gevonden dat myosine V zich naast Golgi bevindt.
- In gisten onderbreekt mutaties in myosine V -gen eiwitafscheiding en bijgevolg accumuleren eiwitten in cytosol.
- Myosine I isovormen zijn belast met het transport van vacuola's naar het celmembraan. Met behulp van specifieke antilichamen tegen myosine I isovormen, bleek dat deze isovormen zich in verschillende delen van de cel bevinden.
Wanneer een levende amoeba bijvoorbeeld wordt gemarkeerd met een antilichaam tegen myosine IC, wordt het transport van de vacuole naar het membraan gearresteerd. Daarom breidt de vacuole uit en explodeert de cel.
Myosine -gerelateerde ziekten
Myosinas en verlies van oor
Er zijn talloze genen en mutaties die het verlies van oor produceren. Deze ziekte is vaak monogenetisch .
Mutaties in onconventionele myosinas, met een of twee hoofden van myosine, beïnvloeden het functioneren van het interne oor. Sommige van de gemuteerde myosine -isafforms zijn myosine IIIa, myosin VIIA en myosin xva. Onlangs werden twee mutaties ontdekt in myosine VI.
De mutaties in myosine VI zijn c.897G> T en P.926Q. De eerste mutatie beïnvloedt een gebied dat interageert met de actieve gelokaliseerde, Switch I genoemd. Homozygoot voor mutatie vertoont vroeg het fenotype, waardoor ernstige effecten worden veroorzaakt.
De tweede mutatie beïnvloedt een belastinggebied met belasting, in een alfa -propeller in de staart van myosine VI. Deze regio is belangrijk voor de proximale dimerisatie van de motor en beïnvloedt de stereokaartfunctie van myosine VI.
Het kan u van dienst zijn: Auxiliary Sciences of BiologyEen andere mutatie is p.ASN207Ser, die een motor produceert die niet in staat is om sterkte te produceren. Dit komt omdat ASN 207 een aminozuurresidu is van de actieve plaats, waarvan de functie de unie en hydrolyse van de ATP is.
De mutatie p.Arg657trp produceert het verlies van myosine VI -functie. Het arg -residu is betrokken bij de conformationele veranderingen die hydrolyse hechten aan myosinebewegingen.
Myosine X en kanker
Myosina X (Myo10) is een onconventionele myosine die wordt uitgedrukt in de hersenen, endothelios en vele epitheel. Myo10 en drie soorten actine -gebaseerde projecties (Philopodes, Invoicids en projecties vergelijkbaar met Philopodians) werken tijdens kankermetastase.
Invasieve kankercellen hebben een groot aantal filopodes en drukken hoge niveaus van fascin uit. Dit eiwit voert kruisen uit tussen actinefilamenten. Om te ontsnappen aan de primaire tumor, worden invaddies gevormd, rijk aan proteolytische activiteit, die de omringende extracellulaire matrix verteren.
Zodra de cellen de extracellulaire matrix bereiken, helpen de projecties vergelijkbaar met filopoden om zich te verspreiden en te koloniseren. Hoge niveaus van MYO10 duiden op hoge agressiviteit en metastase bij borstkanker.
Myox's silencing produceert verlies van het metastatische karakter van cellen, die niet in staat zijn om op actine gebaseerde projecties te vormen. Al deze projecties hebben begrip -gebaseerde verklevingen, die worden getransporteerd door My1010 binnen de Philopodium.
Myox is betrokken bij de vorming van de centra. De afwezigheid van Myox is voorstander van de vorming van multipolaire spikes. Myox is ook betrokken bij signalering in kankercellen. Myox wordt bijvoorbeeld geactiveerd door 3,4,5, -inositol trifosposfaat (PIP3).
Referenties
- Alberts, B., Johnson, a., Lewis, J., en kool. 2007. Biologie van de celmoleculair. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, een., Karfunkel-don, D., Sirigu, s., Davido, B., Shohat, m., Frydman, m., Houdusse, een., Kanaan, m., Avraham, k. 2014. Nieuwe myosinemutaties voor erfelijk gehoorverlies genomen door gerichte genomische vangst en massaal parallelle sequencing. European Journal of Human Genetics, 22: 768-775.
- Courson, D.S. en Cheney, r.EN. 2015. Myosine-x en ziekte. Experimenteel celonderzoek, 334: 10-15.
- Lodish, h., Berk, een., Zipurski, s.L., Matsudaria, p., Baltimore, D., Darnell, J. 2003. Cellulaire en moleculaire biologie. Redactionele medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Schliwa, m. en Woehlke, g. 2003. Moleculaire motoren. Natuur, 422: 759 - 765.
- Naar de waarde.D. 2003. De moleculaire gereedschapskist voor intacellulair transport. Cell, 112: 467-480.
- « Exonuclease -kenmerken, structuur en functies
- Bromo -geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruik »

