Bromo -geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruik

- 3866
- 111
- Dewey Powlowski
Hij broom Het is een niet -metalen element dat behoort tot de halogenen -groep, groep 17 (VIIA) van het periodiek systeem. Het chemische symbool is de BR. Het wordt gepresenteerd als een diatomee molecuul, waarvan de atomen worden verenigd door een covalente binding, dus de moleculaire formule wordt toegewezen2.
In tegenstelling tot fluoride en chloor is broom in terrestrische omstandigheden geen gas maar een roodbruine vloeistof (lager beeld). Het is roken, en het is samen met kwik, de enige vloeibare elementen. Daaronder kan het jodium, hoewel de kleur intensiveert en paars wordt, kristalliseren in een vluchtige vaste stof.
 Flacon met pure vloeibare broom. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Flacon met pure vloeibare broom. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] De Bromo werd in 1825 onafhankelijk ontdekt door Carl Löwig, die studeerde onder leiding van de Duitse chemicus Leopold Gmelin; En in 1826, door de Franse chemicus Antoine-Jerome Ballard. De publicatie van de experimentele resultaten van Balard ging echter vooraf aan die van Löwig.
Bromo is het 62e meest voorkomende element op aarde, die in lage concentraties wordt verdeeld door de cortex van de aarde. In de zee is de gemiddelde concentratie 65 ppm. Het menselijk lichaam bevat een broom van 0,0004 %, niet definitief de functie ervan kennen.
Dit element wordt commercieel geëxploiteerd in de Salmuelas of plaatsen die door speciale omstandigheden hoge zouten zijn; Bijvoorbeeld de Dode Zee, waaraan de wateren van de aangrenzende gebieden, verzadigd met zouten samenkomen.
Het is een corrosief element dat in staat is metalen aan te vallen, zoals platina en paladium. Opgelost in water, kan broom ook zijn corrosieve werking op menselijke weefsels uitoefenen, waardoor de situatie verergert omdat bromhyterinezuur kan worden gegenereerd. Wat betreft de toxiciteit ervan, kan het belangrijke schade veroorzaken aan organen, zoals lever, nieren, long en maag.
De broom is zeer schadelijk in de atmosfeer en is 40-100 keer destructiever voor de ozonlaag dan chloor. De helft van het verlies van de ozonlaag in Antarctica wordt geproduceerd door reacties gerelateerd aan bromomethyl, verbinding gebruikt als een fumigant.
Het heeft talloze toepassingen, zoals: brandvertrager, bleekmiddel, oppervlakte -desinfectiemiddel, brandstofadditief, intermediair in sedatieve productie, bij de vervaardiging van organische chemicaliën, enz.
[TOC]
Geschiedenis
Carl Löwig werk
De Bromo werd onafhankelijk en bijna gelijktijdig ontdekt door Carl Jacob Löwig, een Duitse chemicus in 1825, en door Antoine Balard, een Franse chemicus in 1826.
Carl Löwig, een discipel van de Duitse chemicus Leopold Gmelin, verzamelde water uit een veer van slechte Kreuznach en voegde chloor toe; Na de toevoeging van de ether roerde hij het mengsel van vloeistoffen.
Vervolgens werd de ether gescheiden door destillatie en concentreerde deze door verdamping. Als gevolg hiervan verkreeg hij een roodachtige bruine stof, die de broom was.
Antoine Balard werk
Balard daarentegen gebruikte as van een bruine alga. Aldus ging de vrijgegeven bromo, chloor passeerde door het waterige materiaal dat werd onderworpen aan extractie, waarin het magnesiumbromide, mgBr was aanwezig2.
Vervolgens werd het materiaal gedestilleerd in aanwezigheid van mangaandioxide en zwavelzuur, waardoor rode dampen produceerden die in een donkere vloeistof zijn gecondenseerd. Balard vond het een nieuw element en noemde hem Muride, afgeleid van het Latijnse woord Muria, waarmee de pekel werd aangewezen.
Het kan u van dienst zijn: Living Matter: Concept, Kenmerken en voorbeeldenEr is erop gewezen dat Balard de naam van Muride in Brôme heeft veranderd door een suggestie van Anglada of Gay-Lussac, gebaseerd op het feit dat Brôme pestilent betekent, dat de geur van het ontdekte element definieert.
De resultaten werden gepubliceerd door Belard in Annales of Chemie and Physique, voordat Löwig de zijne publiceerde.
Alleen vanaf 1858 werd broom in belangrijke hoeveelheden geproduceerd; Jaar waarin Stassfurt -zoutafzettingen werden ontdekt en geëxploiteerd, waardoor broom werd verkregen.
Elektronische bromo -structuur en configuratie
Molecuul
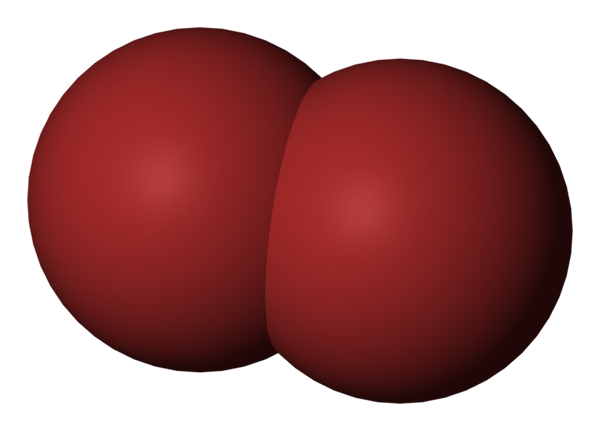 BR2 -molecuul. Bron: Benjah-bmm27 [Public Domain].
BR2 -molecuul. Bron: Benjah-bmm27 [Public Domain]. In het bovenste beeld wordt het broommolecuul getoond, Br2, Met een compact vulmodel. Eigenlijk is er een eenvoudige covalente binding tussen de twee broomatomen, BR-BR-BR.
Als een diatomee en homogeen molecuul, mist het permanent dipoolmoment en kan het alleen communiceren met anderen van hetzelfde type via dispersiekrachten in Londen.
Dit is de reden waarom uw roodachtige vloeistof rookt; In BR -moleculen2, Hoewel ze relatief zwaar zijn, houden hun intermoleculaire krachten ze zwak verbonden.
Bromo is minder elektronegatief dan chloor en heeft daarom een lager attractie -effect op de elektronen van de Valencia -lagen. Als gevolg hiervan vereist het minder energie om hogere energieniveaus te reizen, groene fotonen te absorberen en een roodachtige kleur weer te geven.
Kristallen
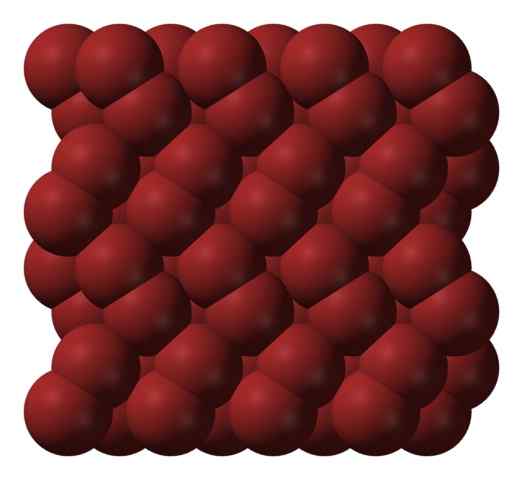 Bromo kristallijne structuur. Bron: Ben Mills [Public Domain].
Bromo kristallijne structuur. Bron: Ben Mills [Public Domain]. In een gasfase, BR -moleculen2 Ze scheiden aanzienlijk totdat er efficiënte interacties tussen hen zijn. Onder het smeltpunt kan broom echter worden ingevroren in roodachtige orthorrombische kristallen (superieure afbeelding).
Merk op hoe BR Moleculen2 Ze zijn zo ordelijk gepositioneerd dat ze "broomwormen" lijken. Hier en bij deze temperaturen (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valencia -laag en oxidatietoestanden
De elektronische broomconfiguratie is:
[AR] 3D104S2 4P5
3D zijn104S2 4P5 zijn valentielaag (hoewel de 3D -orbitaal10 Heb geen prominentie in uw chemische reacties). De elektronen van de 4s en 4p orbitalen zijn de buitenste en voegen in totaal 7, slechts één elektron toe om het octet van Valencia te voltooien.
Uit deze configuratie kunnen de mogelijke oxidatietoestanden worden afgeleid voor broom: -1, als een elektron wint dat isolectronisch is voor de Kripton; +1, als 3D104S2 4P4; +3, +4 en +5, die alle elektronen van de 4p orbital verliest ([ar] 3D104S24P0); en +7, rennen zonder elektronen in de 4s orbital ([AR] 3D104S04P0)).
Eigenschappen
Fysiek uiterlijk
Kleine donkerbruine roodachtige vloeistof. Het wordt in de natuur gevonden als een diatomisch molecuul, met atomen verenigd door een covalente binding. Bromo is een dichtere vloeistof dan water en zinkt erin.
Kan u van dienst zijn: radio: structuur, eigenschappen, gebruik, verkrijgenAtoomgewicht
79.904 g/mol.
Atoomnummer
35.
Geur
Een hectare rook, verstikkend en irritant.
Smeltpunt
-7.2 ºC.
Kookpunt
58,8 ºC.
Dichtheid (Br2) vloeistof
3.1028 g/cm3
Oplosbaarheid in water
33,6 g/l A 25 ° C. De oplosbaarheid van broom in water is laag en heeft de neiging om te stijgen door de temperatuur te verlagen; gedrag vergelijkbaar met andere gassen.
Oplosbaarheid
Vrij oplosbaar in alcohol, ether, chloroform, koolstoftetrachloride, koolstofdisulfide en geconcentreerd zoutzuur. Oplosbaar in niet -polaire oplosmiddelen en sommige polair zoals alcohol, zwavelzuur en in veel gehalogeneerde oplosmiddelen.
Drievoudige punt
265,9 K bij 5,8 kPa.
Kritisch punt
588 K bij 10.34 MPa.
Fusiewarmte (Br2))
10.571 kJ/mol.
Verdampingswarmte (Br2))
29,96 kJ/mol.
Molaire caloriecapaciteit (Br2))
75,69 kJ/mol.
Dampdruk
Bij een temperatuur van 270 K, 10 kPa.
Zelf -uitsluittemperatuur
Niet ontvlambaar.
ontstekingspunt
113 ºC.
Bewaar temperatuur
2 tot 8 ºC.
Oppervlaktespanning
40,9 mn/m A 25 ºC.
Geurdrempel
0,05 - 3,5 ppm. 0,39 mg/m3
Brekingsindex (ηd)
1.6083 tot 20 ºC en 1.6478 tot 25 ºC.
Elektronegativiteit
2.96 op de Pauling -schaal.
Ionisatieenergie
- Eerste niveau: 1.139,9 kJ/mol.
- Tweede niveau: 2.103 kJ/mol.
- Derde niveau: 3.470 kJ/mol.
Atomaire radio
120 uur.
Radiocovolent
120.3 uur.
Van der Waals radio
185 uur.
Reactiviteit
Het is minder reactief dan chloor, maar reactiever dan jodium. Het is een oxidatiemiddel minder sterk dan chloor en sterker dan jodium. Het is ook een zwakker reductiemiddel dan jodium, maar sterker dan chloor.
Chloorstoom is zeer corrosief voor veel materialen en menselijke weefsels. Het valt vele metalen elementen aan, waaronder platina en paladium; Maar het valt geen lead, nikkel, magnesium, ijzer, zink en minder dan 300 ºC aan het natrium aan.
Bromo in het water ervaart een verandering en verandert in bromide. Het kan ook bestaan als een bromaat (bro3-), Afhankelijk van de vloeibare pH.
Vanwege de oxiderende werking kan bromine de afgifte van zuurstofvrije radicalen induceren. Dit zijn sterke oxidatiemiddelen en kunnen weefselschade veroorzaken. Ook kan broom spontane ontsteking veroorzaken in combinatie met kalium, fosfor of tin.
Toepassingen
Benzine -additief
Ethyleendibromide werd gebruikt om mogelijke loodafzettingen in auto's te elimineren. Na de verbranding van benzine, die lood als een additief gebruikte, combineerde de broom met lood om loodbromide te vormen, een vluchtig gas dat werd uitgezet door de uitlaatbuis.
Terwijl de broom het lood uit benzine elimineerde, was de destructieve actie op de ozonlaag zeer krachtig, daarom werd deze weggegooid voor deze toepassing.
Pesticiden
Methyleen of bromethylbromide werd gebruikt als een pesticide om bodems te zuiveren, vooral om parasitaire nematoden te elimineren, zoals AnyLostome.
Het gebruik van de meeste verbindingen die broom bevatten, is echter opnieuw weggegooid op de ozonlaag.
Mercuriusuitgifte controle
Bromo wordt in sommige planten gebruikt om kwikemissie, zeer giftig metaal te verminderen.
Kan u van dienst zijn: Gravimetrie: Gravimetrische analyse, methoden, gebruik en voorbeeldenFotografie
Zilverbromide wordt naast zilveren yoduro en zilverchloride gebruikt als een lichtgevoelige verbinding in fotografische emulsies.
Therapeutische acties
Kaliumbromide, evenals lithiumbromide, werden gebruikt als algemene sedativa in de 19e eeuw en het begin van de twintigste eeuw. Eenvoudige zouten worden nog steeds gebruikt in sommige landen, zoals anticonvulsies.
De FDA van de Verenigde Staten keurt echter het gebruik van broom niet goed voor de behandeling van een ziekte vandaag.
Brandweer
De broom wordt door de vlammen getransformeerd in bromhorinezuur, die de oxidatiereactie die tijdens het vuur optreedt, interfereert en zijn uitsterven produceert. Polymeren bevatten broom worden gebruikt om harsen aan brandvertraging te maken.
Voedseladditief
Kaliumbromaatsporen aan bloem zijn toegevoegd om het koken te verbeteren.
Chemische reagentia en tussenpersoon
Waterstofbromide wordt gebruikt als een reductiemiddel en katalysator voor organische reacties. Bromo wordt gebruikt als een chemische tussenpersoon bij de productie van geneesmiddelen, hydraulische vloeistoffen, koelmiddelen, ontvochtigers en in voorbereidingen om haar te golven.
Het vindt ook gebruik bij de uitwerking van putboorvloeistoffen, producten voor waterdesinfectie, witachtige middelen, oppervlakte -desinfectiemiddelen, kleurstoffen, brandstofadditieven, enz.
Biologische actie
Een studie uitgevoerd in 2014 geeft aan dat broom een noodzakelijke cofactor is voor biosynthese van collageen IV, waardoor broom een essentieel element maakt voor de ontwikkeling van dierenweefsel. Er is echter geen informatie over de gevolgen van een tekort van het element.
Waar bevindt het zich
Bromo wordt commercieel geëxtraheerd uit zoutmijnen en diepe Salmuelas -putten gevonden in de staat Arkansas, en in het grote zoute meer van Utah, beide in de Verenigde Staten. Deze laatste pekel heeft een broomconcentratie van 0,5 %.
Om broom te extraheren.
De Dode Zee, aan de grens tussen Jordanië en Israël, is een gesloten zee die zich onder zeespiegel bevindt, waardoor het een zeer hoge concentratie zouten is.
Bromo en Potassa worden daar commercieel verkregen, door verdamping van water met een hoog zout van de Dode Zee. In deze zee kan de broomconcentratie 5 g/l bereiken.
Het wordt ook gevonden in hoge concentraties in sommige hete bronnen. De Bominita is bijvoorbeeld een zilveren bromide -mineraal gevonden in Bolivia en Mexico.
Risico's
De broom in vloeibare toestand is corrosief voor menselijke weefsels. Maar het grootste gevaar voor de mens komt van broomdampen en inademing.
Adem een omgeving in met een broomconcentratie van 11-23 mg/m3 Het levert ernstige schokken op. Een concentratie van 30-60 mg/m3 Het is uiterst schadelijk. Ondertussen kan een concentratie van 200 mg fataal zijn.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Nationaal centrum voor biotechnologie -informatie. (2019). Broom. PubChem -database. CID = 23968. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Ross Rachel. (8 februari 2017). Feiten over broom. Hersteld van: livescience.com
- Wikipedia. (2019). Borax. Opgehaald uit: in.Wikipedia.borg
- Lentech B. V. (2019). Broom. Hersteld van: Lentech.com
- « Myosine -kenmerken, structuur, typen en functie
- Nucleas -kenmerken, structuur, typen en functies »

