Alkalineter metalen
- 1447
- 333
- Glen Armstrong
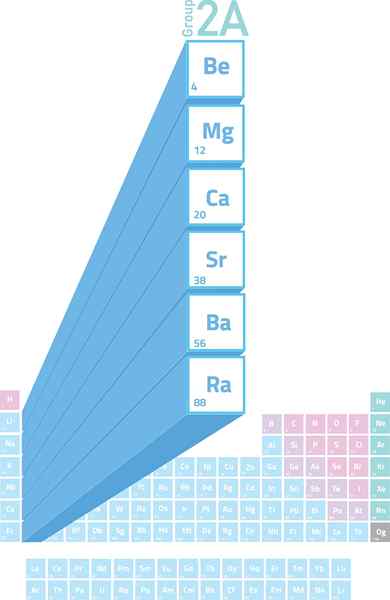
 Locatie van alkalinotherreuze metalen in het periodiek systeem
Locatie van alkalinotherreuze metalen in het periodiek systeem Wat zijn alkaliney metalen?
De Alkalineter metalen Ze zijn de elementen van groep 2 (voorheen Groep 2a genoemd) van het periodiek systeem. Dat wil zeggen dat ze worden gevormd door de 6 elementen van de tweede kolom van de periodiek systeem, variërend van beryllium (BE) tot de radio (RA).
Ze zijn een groep vrij reactieve en relatief veel voorkomende metaalelementen. Ze hebben slechts twee valentie -elektronen in een orbitale S. Om deze reden behoren ze tot blok S van het periodiek systeem.
De naam "alkalinoterreo" komt van de unie van "alkalische" woorden, die een andere manier is om basis te zeggen, en aarde, wat hen werd verteld vóór oxiden. Dus alkalinotherreuze metalen betekent letterlijk metalen die basisoxiden vormen.
Deze metalen hebben veel toepassingen die ze belangrijk maken in onze huidige samenleving, vooral magnesium. Deze toepassingen zijn te wijten aan hun specifieke eigenschappen, die hieronder worden beschreven.
Eigenschappen van alkalinotherrous metalen
Ze hebben een metaal uiterlijk
Alle alkalinotherreuze metalen hebben zilveren kleur met metalen helderheid. De radon is ook radioactief, dus hij schijnt in het donker dat een karakteristiek groen licht uitstraalt.
Het zijn kleine dichte metalen
Alle alkalinotherreuze metalen zijn dichter dan water, maar zijn minder dicht dan de meeste andere metalen elementen in het periodiek systeem.
De dichtheden in deze groep variëren van 1,54 g/cm3 Voor calcium tot 5,5 g/cm3 Voor de radio, die aanzienlijk minder is dan de dichtheden van andere metalen zoals ijzer (7,9 g/cm3), koper (9,0 g/cm3), lood (11,3 g/cm3) en El Mercurio (13,5 g/cm3), om er een paar te noemen.
Ze hebben relatief lage smelt- en kookpunten
Als metalen zijn de smelt- en kookpunten groter dan die van de meeste niet -metalen. Ze zijn echter lager dan de fusie- en kookpunten van de meeste andere metalen, op enkele uitzonderingen na.
Kan u van dienst zijn: Arrhenius -vergelijkingZe hebben Valencia +2
Vanwege hun elektronische configuratie verliezen deze metalen de neiging twee elektronen te verliezen wanneer ze reageren met andere elementen zoals niet -metalen. Om deze reden is zijn enige Valencia +2.
Ze zijn relatief reactief
Alkalinotherreuze metalen zijn veel reactiever dan metalen zoals ijzer of koper, maar zijn minder reactief dan alkalische metalen (de elementen van groep 1). Hoe lager de groep, hoe reactiever het metaal is.
Beryllium (de eerste van de groep) reageert bijvoorbeeld niet met water, terwijl de volgende twee kunnen reageren met heet water en de laatste kunnen zelfs reageren met koud water.
Reageren met lucht om basisoxiden te vormen
Deze metalen hebben de neiging basisoxiden te vormen wanneer ze reageren met luchtzuurstof. Dit is in feite, dit is de reden waarom ze alkaliners worden genoemd. Deze oxiden worden bij het oplossen in water hydroxiden die alkalische of basisoplossingen produceren.
Alkalinotherrous metaaltoepassingen
In de technologie -industrie
Sommige van de alkalinotherische metalen worden gebruikt bij de productie van halfgeleiders. Deze zijn essentieel bij de constructie van elektronische circuits, zoals die die vrijwel alle moderne elektrische apparaten bevatten, van computers en mobiele telefoons tot wasmachines, auto's en andere.
In de voedingsindustrie
Calcium is een essentiële voedingsstof voor het leven. Het maakt deel uit van de structuur van de botten en heeft andere belangrijke functies in het lichaam. Om deze reden wordt dit element toegevoegd als een fortifier voor veel voedsel, van granen tot zuivelproducten. Bovendien wordt het ook gebruikt in kaasproductie.
Het kan u van dienst zijn: Circonium: geschiedenis, eigenschappen, structuur, risico's, gebruikIn de auto -industrie
Sommige alkalinotherreuze metalen hebben zeer goede mechanische eigenschappen, wat betekent dat ze hard en resistent zijn. Bovendien zijn ze corrosiebestendig, dus ze worden vaak gebruikt bij de productie van luxe wielen voor auto's en andere delen ervan.
In de militaire industrie
Vanwege hun mechanische eigenschappen en lage dichtheid worden metalen zoals magnesium en beryllium gebruikt bij de constructie van gevechtsvliegtuigen, satellieten en helikopters.
Vanwege hun elektrische eigenschappen worden ze bovendien ook gebruikt bij de productie van verschillende soorten sensoren en optische en elektronische systemen die de militaire industrie gebruikt om wapens en communicatiesystemen te creëren.
De zes alkalische metalen
Er zijn slechts zes alkalische metalen. Vervolgens is er een korte beschrijving van elk van hen:
Beryllium (be)
Het is element nummer 4 van de periodiek systeem en de eerste van de groep alkalinotherrous metalen. Het is een zeer licht, sterk metaal met unieke eigenschappen die het nuttig maken bij de productie van halfgeleiders.
Magnesium (mg)
Magnesium is een relatief licht zilvermetaal, met een laag smelt- en kookpunt (vergeleken met andere metalen). Het is erg hard en resistent en wordt vaak gebruikt bij de productie van auto -onderdelen en als additief bij de bereiding van legeringen zoals bepaalde soorten staal.
Het is het tweede alkalinother metaal- en elementnummer 12 van de periodiek systeem. Net als andere elementen in deze groep, is het een essentiële voedingsstof voor het leven.
Calcium (CA)
Calcium is het 5e meest voorkomende element in de cortex van de aarde. Het wordt gevonden als calciumcarbonaat in veel mineralen en rotsen en is ook een essentieel element voor het leven vanwege de deelname aan de vorming van botten en het belang ervan in het zenuwstelsel.
Kan u van dienst zijn: strontiumchloride (srcl2)Dit metaal is element nummer 20 van de periodiek systeem, bevindt zich in de vierde periode en is het derde alkalinotheraal metaal.
Strontium (SR)
Het elementnummer 38 en vierde alkalisch metaal is strontium. Het is zwaarder dan calcium, maar het lijkt veel in termen van zijn chemische en fysische eigenschappen. Strontium kan in feite calcium in botten vervangen.
Dit is vooral problematisch wanneer we onszelf blootstellen aan radioactief strontium dat optreedt na een nucleaire reactie, omdat het, wanneer ze zich aan de botten houden, erg moeilijk is om uit het lichaam te elimineren en ons beetje bij beetje vergiftigt met straling.
Barium (BA)
Dit element heeft atoomnummer 56 en heeft ook eigenschappen die vrij vergelijkbaar zijn met die van calcium en strontium. Het is een nogal zacht en zeer reactief metaal dat niet elementair van aard is. Het is een van de alkalinotherreuze metalen met een groter metaalkarakter.
Radio (RA)
Het laatste element van de Alcalinoterreos -groep is de radio, een radioactief metaal (vandaar zijn naam) dat een zwak groen licht uitzendt dat gemakkelijk te observeren is in het donker.
Vroeger werd het veel gebruikt bij de voorbereiding van schilderijen die in het donker schijnen, maar nadat het gevaar van gezondheid is ontdekt, was het gebruik ervan verboden.

