Isopreno -structuur, eigenschappen, toepassingen
- 2093
- 328
- Ernesto McKenzie
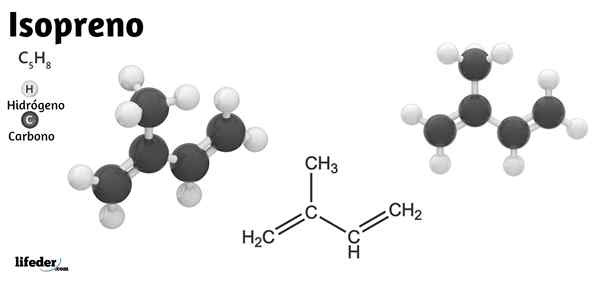
Hij Isopreen of 2-methyl-1,3-butadieen, het is een organische verbinding die bestaat uit een koolwaterstof waarvan de moleculaire formule c is5H8. Ondanks zijn schijnbare eenvoud, vertegenwoordigt het de structurele basis van natuurlijk rubber en, nog belangrijker, het skelet van de biologische eenheden waarmee isoprenoïden of terpenen enzymatisch worden gesynthetiseerd.
Daarom houdt het isopreen prominentie niet alleen in organische chemie, maar ook in de biochemie. In het onderste beeld is de structurele formule te zien, die lineair kan worden afgebroken als cho2= C (Ch3) −ch = cho2. Uit deze formule is het begrepen waarom de naam IUPAC 2-methyl-1,3-butadieen is, omdat de twee dubbele obligaties zich bevinden in koolstoffen 1 en 3.
Isopreen is een aanzienlijk veel voorkomende koolwaterstof in de omgeving. Planten, algen, bacteriën en dieren kunnen het synthetiseren en uitzenden, en vormen zelfs het meest voorkomende deel van onze uitademingen. Groentemassa's zijn de belangrijkste producenten en isopreenemitters, die het gebruiken in mechanismen om de buitenwarmte te weerstaan.
Biochemisch gezien wordt het isopreen in zijn biologische eenheid gebruikt door organismen om verschillende soorten terpenen te synthetiseren, waaronder Laundhen en de componenten van etherische oliën opvallen. Organisch dient het voor de synthese van synthetische rubbers en andere gerelateerde polymeren.
[TOC]
Isopreen -structuur
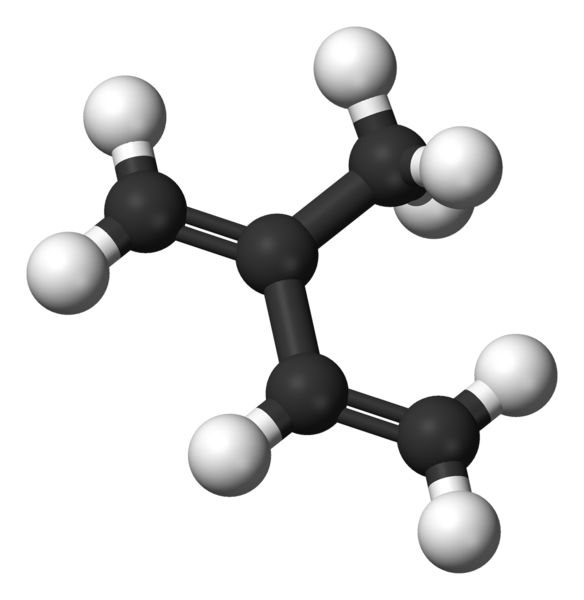 Isopreen -molecuul vertegenwoordigd door een model van bollen en staven
Isopreen -molecuul vertegenwoordigd door een model van bollen en staven In het superieure beeld hebben we de moleculaire structuur van het isopreen. Zoals gezien, komen de zwarte bollen overeen met koolstofatomen, terwijl wit waterstofatomen zijn.
Het molecuul presenteert een vlakke geometrie, dat wil zeggen dat al zijn atomen in hetzelfde vlak zijn gerangschikt, behalve de hydrogenen van de groep -ch3 Koolstof gekoppeld 2. Deze geometrie is te wijten aan het feit dat koolstofatomen van het skelet van 1,3 butadieen SP Hybracy hebben2, terwijl de koolstof van -CH3 Het heeft sp3.
Kan u bedienen: Bromine: geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruikIsopreen -moleculen interageren met elkaar door dispersieve Londense krachten, die aanzienlijk zwak zijn vanwege hun lage moleculaire massa's. Ze oefenen echter voldoende cohesie uit zodat het isopreen bestaat als een vluchtige vloeistof onder normale omstandigheden.
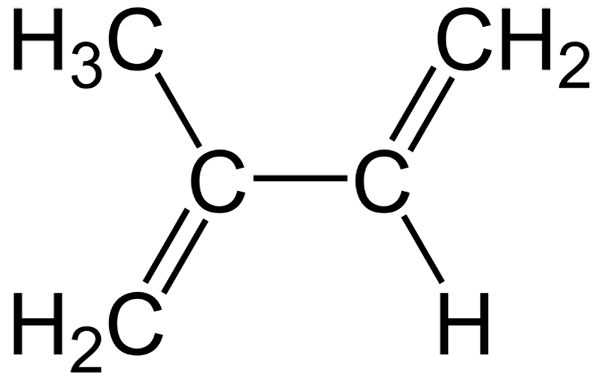 Structurele formule van het isopreen
Structurele formule van het isopreen Het feit dat hun moleculen plat zijn, vergemakkelijkt hun invoeging tussen celmembranen, wat bijdraagt aan hun versterkingen in het mechanisme dat planten gebruiken om plotselinge temperatuurveranderingen te dempen (40 ° C of meer).
Isopreenmoleculen kunnen kristallen vormen. Maar het gebeurt niet op dezelfde manier met hun polymeren, het polyaprene, dat de neiging heeft om te groeperen in amorfe vaste stoffen, waarvan de gemiddelde moleculaire massa's veel groter zijn en ophouden een vluchtige stof te zijn.
Isopreen -eigenschappen
De hier genoemde eigenschappen komen overeen met die van het isopreen en niet met die van het natuurlijke rubber, dat bestaat uit het polymeer CIS-1,4-polisopreen. Sommige bibliografische bronnen kunnen zelfs de eigenschappen van de latex vers uit de bomen gebruiken om het isopreen te karakteriseren, een ernstige fout om ze te verwarren.
Verschijning
Kleurloos en vluchtige vloeistof met een geur vergelijkbaar met olie.
Molaire massa
68.12 g/mol
Smeltpunt
-143.95 ºC
Kookpunt
3. 4.067 ºC. Daarom is het een vrij vluchtige vloeistof.
Flitspunt
-54 ºC (gesloten beker)
Zelf -richtingtemperatuur
395 ºC
Dikte
0.681 g/cm3
Stoomdichtheid
2.35 met betrekking tot lucht.
Dampdruk
550 mmHg bij 25 ° C, wat in overeenstemming is met zijn grote volatiliteit.
Oplosbaarheid
Een koolwaterstof zijn is niet -mengbaar met water, gelegen in zijn mengsels hierboven omdat het minder dicht is. Het is echter mengbaar met aceton, benzeen, oliether, koolstofdisulfide, dichloormethaan en praktisch met een ander aromatisch of gechloreerd oplosmiddel.
Kan u van dienst zijn: Type link van 02Oppervlaktespanning
16.9 DIN/cm.
Reactiviteit
Het isopreen kan nucleofilisch reageren (aangevallen door elektronenrijke soorten) door hun koolstofatomen 1 en 4. Aldus kan het aan de uiteinden van zijn koolstofskelet polymeer zijn, wat aanleiding geeft tot polyaprene. Deze polymerisatiereactie is exotherme, in die mate dat het in contact met sommige stoffen explosief kan worden.
Biologische eenheden
Het isopreen, hoewel intrinsiek aanwezig in de structuren van de terpenen, is niet het uitgangsmateriaal dat door enzymen wordt gebruikt om ze te synthetiseren. In plaats daarvan gebruiken ze metabole producten genaamd isopentenyl (IPP, blauw) en dimethylalil pyrofosfaat (DMAPP, rood) pyrofosfaatproducten als substraten (DMAPP, rood).
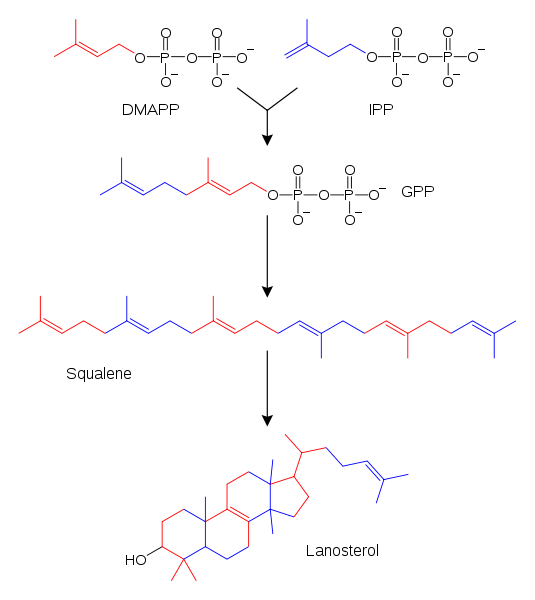 Loosterol -synthese van de biologische eenheden van het isopreen. Bron: FvasConcellos, origineel door Tim Vickers / Public Domain
Loosterol -synthese van de biologische eenheden van het isopreen. Bron: FvasConcellos, origineel door Tim Vickers / Public Domain In het superieure beeld een voorbeeld van het bovengenoemde hierboven. Zowel, zowel de IPP als de DMAPP, reageren met elkaar dankzij de enzymatische interventie om geranilo pyrofosfaat (GPP) te veroorzaken.
De laatste bevat op zijn beurt andere moleculaire fragmenten van IPP of DMAPP (zie kleuren), totdat het het escuualeen wordt, een waardevolle voorloper voor de synthese van de wol.
Vervolgens neemt het isopreen in zijn biologische eenheid (IPP of DMAPP) deel aan de biosynthese van sterolen en andere lipiden. We hebben ook terpenen, zoals limoneen (van citroen- en oranje oliën) en Mirceno (arrayán -olie), die etherische oliën vormen, en die worden gesynthetiseerd door chemische processen en structureel vergelijkbaar vergelijkbaar.
In deze zin is de isopreeneenheid, soms duidelijk herkenbaar in de terpenen of isoprenoïden, essentieel voor de synthese van symfines van natuurlijke producten.
Kan u van dienst zijn: legeringIsopreen -toepassingen
 Een van de belangrijkste isopreenrubbertoepassingen is de productie van autobanden
Een van de belangrijkste isopreenrubbertoepassingen is de productie van autobanden Het isopreen is gepolymeriseerd in natuurlijk rubber, dus al zijn toepassingen kunnen op een indirecte manier aan deze verbinding worden toegeschreven. Het maakt deel uit van de gutapercha, elastisch materiaal gemaakt met een mengsel van cis en trans-polymeren 1,4-polisopren, die ooit gebruikte voor de productie van golfballen.
Het rubber dient voor de uitwerking van ballen, slangen, handschoenen, condooms, laarzen, accessoires van elektrische instrumenten, lijmen, duikpakken, flessen voor flessen, coatings die trillingen neutraliseren; En bovenal wordt het gebruikt, samen met de synthetische versie, het isopreenrubber, voor de massaproductie van banden.
Het isopreen kan, net als polygreen, worden gemengd met andere polymeren, zoals stretch-butadieen of wrijvende rubbers met alleen butadieen, om nog meer resistente en duurzame materialen te produceren. Dat wil zeggen, het wordt gebruikt voor de synthese van verschillende elastische copolymeren.
Buiten de rubberindustrie is het isopreen bestemd als een uitgangsmateriaal voor de synthese van vitamines, smaakstoffen, steroïden, geuren en elke andere isopreenide -stof die levensvatbaarder is om het te synthetiseren dan om het te verkrijgen uit natuurlijke bronnen uit bronnen.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Isopreen. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Isopreen. PubChem Comunund Samenvatting voor CID 6557. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Elsevier B.V. (2020). Isopreen. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Database van polymeereigenschappen. (2020). Isopreenrubber: eigenschappen en toepassingen. Hersteld van: polymerdatabase.com
- « Eenheden ionische kracht, hoe het te berekenen, voorbeelden
- Dihydroxyacetonstructuur, eigenschappen, het verkrijgen, gebruiken »

