Eenheden ionische kracht, hoe het te berekenen, voorbeelden

- 3718
- 567
- Glen Armstrong
De Ionische kracht Het is een manier om de concentratie ionen in een oplossing uit te drukken. Dit concept werd in 1922 geïntroduceerd door Lewis en Randall terwijl hij werkte aan de beschrijving van de chemische activiteitscoëfficiënt.
Wanneer de concentratie van de ionen in een oplossing hoog is, wordt een elektrostatische interactie tussen de tegenovergestelde ionen geproduceerd; Dat wil zeggen, kationen en anionen worden sterk aangetrokken, wat resulteert in een effectieve of reële ionische concentratie is minder dan die berekend voor een bepaalde chemische reactie.
 De ionische kracht van zeewater is hoog, rond 0.7, vanwege de grote concentratie van opgeloste zouten
De ionische kracht van zeewater is hoog, rond 0.7, vanwege de grote concentratie van opgeloste zouten Om deze reden werd het concept van chemische activiteit geïntroduceerd als de effectieve ionische concentratie van een oplossing, waarbij de chemische activiteit het product was van de molariteit van de oplossing door de chemische coëfficiënt.
Deze coëfficiënt heeft een waarde in de buurt van eenheid (1) voor verdunde ionische oplossingen en voor de zo -aangedreven ideale oplossingen. Dit zijn oplossingen waarbij intermoleculaire interactie tussen vergelijkbare moleculen gelijk is aan die bestaan tussen verschillende moleculen.
Het creëren van het concept van ionische kracht heeft bijgedragen aan de verklaring van afwijkingen van ideaal gedrag, waargenomen in reële ionische oplossingen.
[TOC]
Ionische krachtenheden
De ionenkracht heeft als eenheden mol/l (molariteit) of mol/kg water (molealiteit). De laatste wordt aanbevolen in niet -ideale oplossingen, die worden gekenmerkt omdat de volumes van hun mengsels niet helemaal additieven zijn.
Dit betekent bijvoorbeeld het volgende: indien gemengd 0.5 liter vloeistof a en 0.5 liter een B -vloeistof, het resulterende volume van dit mengsel, zal niet noodzakelijkerwijs gelijk zijn aan 1 liter, maar kan anders zijn.
De ionische kracht wordt weergegeven door het symbool i.
Kan u van dienst zijn: butanal: structuur, eigenschappen, gebruik en risico'sHoe u ionische kracht kunt berekenen?
Voor de berekening van de ionische kracht van een oplossing wordt rekening gehouden met de concentratie van alle in de oplossing aanwezige ionen, evenals hun respectieve valenties.
De ionische krachtwaarde wordt verkregen door de volgende formule toe te passen:
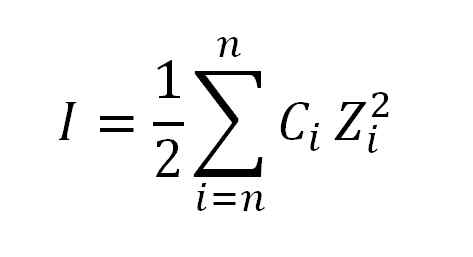 Formule die wordt gebruikt om ionenkracht te berekenen. Bron: Gabriel Bolívar.
Formule die wordt gebruikt om ionenkracht te berekenen. Bron: Gabriel Bolívar. Waar ik, zoals reeds gezegd, de ionische kracht is; C, komt overeen met de morele ionische of morele ionenconcentratie; Terwijl Z, hun respectieve valenties vertegenwoordigt (± 1, ± 2, ± 3, enz.)).
De uitdrukking die verschijnt in de formule in de berekening van de ionische kracht (σ) wordt als samenvatting gelezen, dat wil zeggen de som van het product van de molaire concentratie (c) van elk ion dat in de oplossing aanwezig is door zijn Valencia (Z) hoog vierkante.
Zoals te zien is, heeft de valentie van het ion het grootste gewicht in de waarde van de ionenkracht van de oplossing. Bijvoorbeeld: Valencia (z) van Ca is +2, dus z2 Het is hetzelfde 4. Ondertussen, Valencia (z) van Na es +1, en daarom Z2 Het is hetzelfde 1.
Dit wijst erop dat de bijdrage van de Ion CA2+ Tot de waarde van ionische kracht, tot dezelfde molaire ionische concentratie, is het vier keer groter dan die van het naion+.
Belang van ionische kracht
De ionenkracht is een adequate maat voor de ionische concentratie van een oplossing en is de basis voor het vaststellen van de theorie van Debye-Hückel. Deze theorie beschrijft het ideale gedrag van ionische oplossingen.
Ionische kracht dient als basis voor het berekenen van de activiteitscoëfficiënt (γJe), parameter die op zijn beurt de berekening van de chemische activiteit van een ionische verbinding mogelijk maakt, waarbij de chemische activiteit de effectieve en reële concentratie van een ionische verbinding in oplossing is.
Kan u van dienst zijn: aluminium acetaat (AL (CH3COO) 3): structuur, eigenschappen, gebruikDoor de ionische kracht van een oplossing te vergroten, neemt de interactie tussen ionen toe. Verlaag daarom γJe en de chemische activiteit van de ionen.
Een toename van ionenkracht kan de oplosbaarheid van eiwitten in een waterige omgeving verminderen, waarbij deze eigenschap wordt gebruikt voor proteïne -neerslag selectief. High -force ionische krachtsulfaatoplossingen worden gebruikt voor neerslag en zuivering van plasma -eiwitten.
Voorbeelden van ionische krachten
voorbeeld 1
Bereken de ionenkracht van een kaliumchloride -oplossing (KCL) 0.3 m.
KCL dissocieert op de volgende manier:
KCL → K+ + Klet-
We hebben twee ionen: het K -kation+ (Z =+1) en het cl anion- (Z = -1). Vervolgens passen we de formule toe om de ionische kracht i te berekenen:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Merk op dat de Valencia -1 van de CL- Het werd genomen als 1, zijn absolute waarde, omdat anders de ionische kracht gelijk zou zijn aan 0.
Voorbeeld 2
Bereken de ionenkracht van een calciumsulfaatoplossing (geval4) 0.5m
De zaak4 Het dissocieert als volgt:
Geval4 → CA2+ + SW42-
We hebben twee ionen: het ca -kation2+ (Z =+2) en het SO -anion42- (Z = -2). Vervolgens passen we de formule toe om de ionische kracht i te berekenen:
I = 1/2 [C · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Voorbeeld 3
Bereken de ionenkracht van een schokdemper met de uiteindelijke concentraties van dibasisch natriumfosfaat (Na2HPO4) 0.3 m en monobasisch natriumfosfaat (NAH2Po4) 0.4 m.
Dan een2HPO4 Het dissocieert als volgt:
Kan u van dienst zijn: arseenzuur (H3SO4): eigenschappen, risico's en gebruikNA2HPO4 → 2e+ + HPO42-
Terwijl de nah2Po4 Het dissocieert het volgende patroon na:
Nee2Po4 → Na+ + H2Po4-
We gaan door als de vorige oefeningen, dit keer met de HPO -anionen42- (Z = -2) en h2Po4- (Z = -1):
I = 1/2 [C · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Merk op dat NA -concentratie+ Van de NA2HPO4 Het wordt vermenigvuldigd met 2, omdat de concentratie de concentratie dubbel is. Voor het andere zout, nah echter2Po4, De concentratie van NA+ Ja, we vermenigvuldigen het met 1, volgens de stoichiometrie van de oplossingsvergelijking.
Voorbeeld 4
Bereken de ionenkracht van een natriumchloride -oplossing (NaCl) 0.15 m en glucose (c6H12OF6) 0.3 m.
NaCl dissocieert als volgt:
NaCl → NA+ + Klet-
Glucose is echter niet gedissocieerd op ionen omdat het alleen covalente type bindingen in zijn chemische structuur heeft. Daarom is de Valencia de la Glucosa (Z) gelijk aan nul (0). Vervolgens berekenen we het ionische krachtproduct van NaCl:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Ionensterkte. Opgehaald uit: in.Wikipedia.Of
- Dr. David K. Ryan. (S.F.)). Activiteit & ionensterkte Klasse 4 Ryan. [PDF]. Opgehaald uit: Faculy.uml.Edu
- Universiteit van Michigan. (S.F.)). Een meer gedetailleerde blik op de chemische balans. [PDF]. Hersteld van: umich.Edu
- Elsevier B.V. (2020). Ionensterkte. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- C.D. Kennedy. (1990). Ionische stengte en de dinsociatie van zuren. [PDF]. Hersteld van: iubmb.Online bibliotheek.Wiley.com
- « Literaire teksten kenmerken, typen en voorbeelden
- Isopreno -structuur, eigenschappen, toepassingen »

