Hydronio -ion
- 4432
- 839
- Lonnie Rohan
Wat is het hydroniumion?
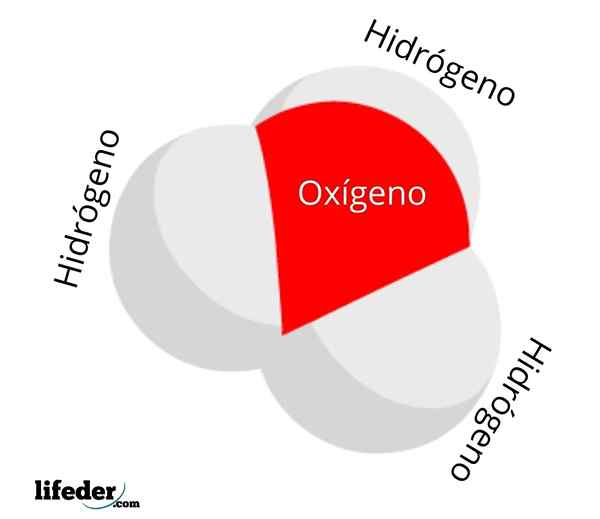
Hij Hydronio -ion Het is een soort positieve belasting die het gevolg is van de protonatie van een watermolecuul, en waarvan de chemische formule is h3OF+. Het bestaat uit de eenvoudigste oxoniërs: ionen waarbij zuurstof een positieve formele belasting draagt en drie covalente bindingen heeft.
De H3OF+ Het is een van de eenvoudigste maar nieuwsgierige kationen die bestaan. In water onder normale omstandigheden heeft het een concentratie van 1 · 10-7 M, product van de zelfbalans. De concentratie ervan neemt echter exponentieel toe wanneer ze sterk is3OF+ Ze lossen op in het water, verzuren het.
 Hydroniumionmolecuul
Hydroniumionmolecuul De concentratie of activiteit van h3OF+ In het water dient het om de zuurgraad van de waterige oplossingen te meten: pH. Hoe meer H -ionen3OF+ Hooi, minder positief zal pH zijn, en meer zuur zal de betreffende oplossing zijn. Deze zuurgraad ligt daarentegen in het waterstofion, h+, die vaak wordt verward met ion h3OF+.
 Ion of hydronio kation formule
Ion of hydronio kation formule De H+ en het verbazingwekkende vermogen om over te dragen tussen de waterstofbruggen van de watermoleculen maakt de h mogelijk3OF+ associëren in meer complexe kationformaties; zoals het kation van Eigen, h9OF4+, en Zundel's kation, h5OF2+, en vele anderen.
Hydronium -ionstructuur
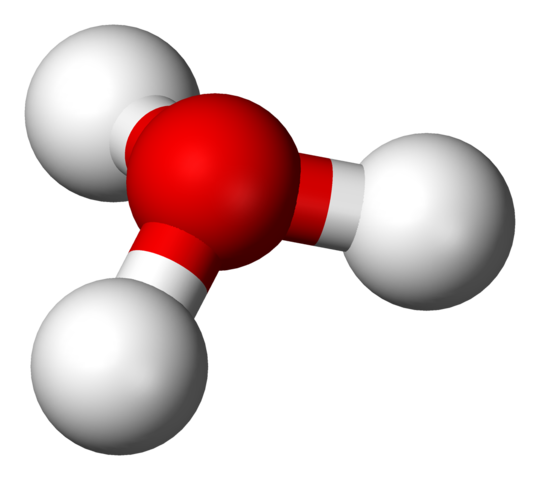 H3O+ structuur met een bollen en barsmodel
H3O+ structuur met een bollen en barsmodel In het eerste beeld kon je de structurele formule van het hydriumion zien. Nu zien we de weergave ervan met een sferen en barsmodel. In beide hoogtepunten is de trigonale piramide-geometrie, waarvan de linkhoeken (O-H) 113º is; Een beetje omgeleid van 119º voor de tetraëder.
Hoewel zuurstof een positieve gedeeltelijke belasting heeft, betekent dit niet dat het negatieve gebied rond waterstofatomen is. Integendeel. Zuurstof in h3OF+ Het is nog meer elektronegatief product van zijn elektronische tekortkoming; Dus alle negatieve dichtheid die wordt gevisualiseerd op een elektrostatische potentiële kaart:
Kan u dienen: kaliumsulfaat (k2SO4): structuur, eigenschappen, gebruik, synthese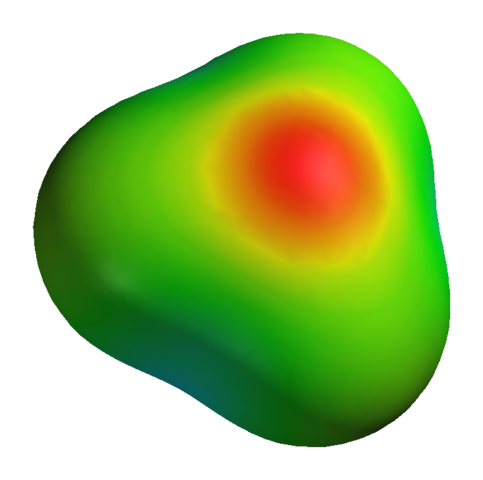 Elektrostatische potentiële kaart voor H3O+
Elektrostatische potentiële kaart voor H3O+ Om nog maar te zwijgen van het feit dat zuurstof een paar vrije elektronen heeft, die nog meer negatieve dichtheid versterkt.
Een gevolg van al het bovenstaande is dat H -hydrogenen3OF+ Ze verliezen de elektronische dichtheid, omdat zuurstof het naar zichzelf aantrekt. Daarom h3OF+ U kunt zeer sterke waterstofbronnen opzetten met een naburig watermolecuul: h2OF+-H-OH2.
Deze interactie is de sleutel achter de verbazingwekkende ionische mobiliteit van H+ en waarom h3OF+ Het kan tegelijkertijd met veel watermoleculen associëren.
Zuurgraad
Hydronio ion is een zeer sterk zuur. In feite is het het sterkste zuur dat kan bestaan in waterige oplossing. Omdat? Omdat elk ander zuur dat sterker is dan hij, zal een watermolecuul protoneren om h te ontstaan3OF+:
HA + H2O → a- + H3OF+
De H3OF+ Het is in staat om stabiel te blijven wanneer er geen andere bases in de omgeving zijn die sterker zijn dan water. Elk zuur heeft hieraan voldaan, zal worden geclassificeerd als een sterk zuur. Ondertussen, als het zuur zwakker is dan h3OF+, Dan zal een deel van HA niet volledig worden gedissocieerd en zullen we het hebben over een zwak zuur:
HA + H2Of ⇌ a- + H3OF+
Daarom, sinds h3OF+ Het is het sterkste zuur dat in het water bestaat, de zuurgraad hiervan zal afhangen van de concentratie van H3OF+. Dit is de basis om in eenvoudige bewoordingen de zuurgraad van een waterige oplossing te definiëren uitgedrukt als pH:
pH = -log [h3OF+]
H+ Vs. H3OF+
Waterstofion en hydronium zijn niet hetzelfde. De H+ Het is veel zuurder dan h3OF+, Welnu, het bestaat uit een proton niets meer, dat naar een molecuul zal zoeken om op alle mogelijke manieren elektronen te krijgen. Wanneer h+ Krijg een watermolecuulvormen H H3OF+:
Het kan u van dienst zijn: KUPRIC OXIDE (CUO)H+ + H2O → H3OF+
Dat is waarom h3OF+ kan worden weergegeven als h+(AC), wat aangeeft dat het een h is+ In waterig medium.
De kracht van een zuur wordt gemeten in zijn vermogen om te doneren, volgens de definitie van Brönsted-Lowry, H-ionen+. Hoeveel sterker is het, hoe meer het zal doneren+, Geen h3OF+. De sterkste zuren ooit gesynthetiseerd (supercids) zijn die waar h+ Hij is "naakt"; dat wil zeggen, zonder enige belemmering om naar het molecuul te springen dat protoneert.
De praktijk van het vertegenwoordigen van h3OF+ als h+(AC) Het is zo gebruikelijk dat er vaak over beide praten alsof ze hetzelfde waren, zonder dat de interpretatie van de chemie van oplossingen negatief beïnvloedt.
Oplossing
De H3OF+ Het kan zeer sterke waterstofbruggen vormen met een aangrenzend watermolecuul. Daarbij hebben we het kation van Zundel, h5OF2+:
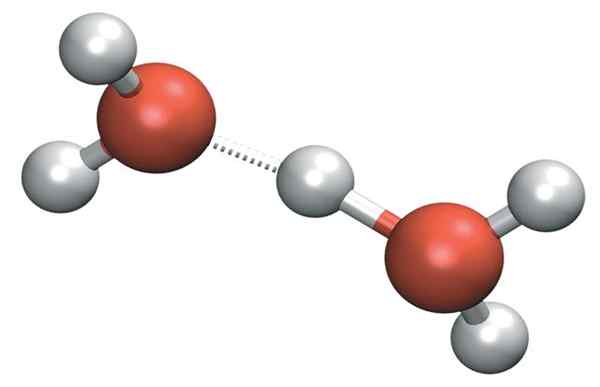 Zundel kation
Zundel kation Maar de positieve belasting blijft niet alleen aan een enkele zijde van het kation: dit kan worden overgebracht naar het andere watermolecuul zoals ion h+:
H2Oh-+Oh2 → h2OF+-H- OH2
Daarom wordt de positieve belasting verdeeld tussen beide zuurstofatomen voor de twee watermoleculen.
In het geval van het eigen kation, h9OF4+, een h3OF+ Vorm waterstofbruggen met drie watermoleculen, waaronder de positieve belasting dankzij een "sprong" h+. Deze sprongen zijn zo snel, dat ze de grote ionische mobiliteit van H verklaren+ In water, met behulp van h3OF+ Als voertuig, en watermoleculen als een snelweg.
De H5OF2+ en h9OF4+ Ze zijn niet de enige kationische associaties die h3OF+ kan afkomstig zijn van water. Sommige moleculaire dynamiekberekeningen tonen het bestaan van een H -cluster aan3OF+(H2OF)twintig: 20 H Moleculen2Of interactie met een H -kation3OF+ en onder hen de positieve belasting verdelen.
Kan u van dienst zijn: neodymium: structuur, eigenschappen, gebruikDaarom h3OF+ en h+ Ze bouwen een nieuwsgierige relatie op met watermoleculen, voorbij zuurgraad.
Je gaat uit
Net zoals organische oxy kamers bestaan, is het geen uitzondering met oxy afgeleid van waterprotonatie. De algemene formule is [h3OF+] [X-], Waar x- Het is elk anion dat voortkomt uit het oplossen van een zeer sterk zuur.
Deze zouten ontvangen soms de naam van 'monohydraatzuren', omdat de formule [h3OF+] [X-] of h3OF+· X- Het kan ook worden geschreven als hx · h2OF. Er kunnen dus dihydraatzuren zijn, Hx · 2H2Of, trihydraten, HX · 3H2Of, etc.
HCl kan bijvoorbeeld kristalliseren als HCl · H2OH3OF+· Cl-. We hebben ook andere hydroniumzouten zoals h3OF+· Clo4- of HCLO4· H2Of, en hbr · 4h2OH3OF+· Br-· 3H2OF.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Inorgán chemieICA. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Hydronium. Opgehaald uit: in.Wikipedia.borg
- Avneet Kahlon & Stephen Lower. (15 augustus 2020). Het hydroniumion. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Helmestine, Anne Marie, pH.D. (25 augustus 2020). Hydronium -ionendefinitie. Hersteld van: Thoughtco.com
- De redacteuren van Enyclopaedia Britannica. (2020). Waterstofion. Hersteld van: Britannica.com

