Chemische traagheid

- 4650
- 1200
- Dr. Rickey Hudson
Wat is chemische traagheid?
Chemische traagheid is de eigenschap met een stof of materiaal om de afbraak te weerstaan die wordt veroorzaakt door externe middelen. In die zin blijven de fysische eigenschappen en, met name chemicaliën, ongewijzigd. Er zijn geen link -pauzes of vorming van nieuwe.
Nu is chemische traagheid relatief. Sommige stoffen of materialen zijn meer inert dan andere, wat te wijten is aan de aard en sterkte van hun interacties. Zoals in principe in principe de fenomenen van verandering zou kunnen contrasteren, onmisbaar dat materie in verschillende producten evolueert.
 Een gouden peep. Goud is corrosie, meer resistent metaal
Een gouden peep. Goud is corrosie, meer resistent metaal Dat is de reden waarom, hoe inert ook dat het een stof of materiaal is, er altijd een toestand zal zijn waaronder het reactief wordt. Goud is bijvoorbeeld de edelste metalen en wordt als inert beschouwd. Het wordt echter aangevallen en opgelost door koninklijk water, een oplossing waarvoor het erg reactief is.
Misschien, en tot op heden, het enige chemische element dat een absolute chemische traagheid heeft aangetoond, is de neon. Er is geen enkele verbinding bekend, zelfs niet onder ultracessure -omstandigheden, zoals die in de kernen van de planeten of manen.
Kenmerken van chemische traagheid
Gebrek aan oxidatie
Om een materiaal of substantie inert te zijn, moet het in principe niet reageren met de omringende lucht. Dit betekent dat het niet de neiging heeft om banden te vormen met zuurstof- of stikstofmoleculen die het oppervlak omringen. Met andere woorden: oxideer de luchtblootstelling niet.
Voedsel en alle organische stoffen in kwestie hebben de neiging om te oxideren. Er wordt daarom gezegd dat ze niet inert zijn.
Gebrek aan oxidatie in chemische traagheid moet worden gehandhaafd bij temperaturen hoger dan 100 ºC. Hoe hoger de temperatuur, de stoffen of materialen zullen sneller beginnen te oxideren, reageren met de zuurstof of stikstof van de lucht om respectievelijk oxiden of nituros te vormen.
Zure resistentie of alkalis
Een ander kenmerk in chemische traagheid is de weerstand tegen zuren of basen. Dit betekent dat een inerte substantie of materiaal de aanval van zuren moet weerstaan, zonder de neiging om af te breken door de acceptatie van H -ionen+ of zeer sterke elektrofielen; of de aanval van de bases, zonder af te breken vanwege de OH -ionen-.
Het kan u van dienst zijn: perbrominezuur (hbro4): eigenschappen, risico's en gebruikNogmaals, dit is relatief, omdat er verschillende soorten zuren en basen zijn. Sommige inerte stoffen kunnen zeer resistent zijn tegen bijvoorbeeld zwavelzuur, maar ze worden afgebroken in plaats van de onderste druppel fluorhoridezuur. Dat is het geval van glazen flessen wanneer ze reageren met HF.
Elektronische stabiliteit
De bovenstaande kenmerken hebben te maken met de thermodynamische stabiliteit afgeleid van de aard van intermoleculaire interacties, naast andere factoren. Aan de andere kant wordt chemische traagheid ook een glimp van de elektronische kenmerken van dezelfde atomen gezien.
Hoe stabieler de elektronische configuratie van een atoom, hoe lager zijn neiging om elektronen te winnen of te verliezen. Daarom zal het grotere chemische traagheid vertonen. Dit is het geval van edelgassen, die in de volgende sectie zullen te zien zijn.
Bioinactiviteit
In de geneeskunde is een stof of materiaal inert als het bioactiviteit mist. Dat wil zeggen, het kan zich in een organisme bevinden zonder te worden geassimileerd tijdens zijn metabolisme. Deze functie is zeer wenselijk in botprothesen, of in weefselreconstructie.
Stralingsweerstand
Ten slotte moeten inerte stoffen of materialen ook resistent zijn tegen straling, ultraviolet of nucleair zijn.
Voorbeelden van chemische traagheid
Glas
 Glas is een relatief inert materiaal
Glas is een relatief inert materiaal Onder de voorbeelden van materialen die chemische traagheid vertonen, hebben we het glas. Als ze niet inert waren, zouden ze niet dienen voor de uitwerking van containers of containers, omdat ze zouden reageren met hun inhoud. Afhankelijk van hun samenstelling, zoals borosilicaten, kunnen ze zeer resistent worden tegen corrosie en temperatuur.
Zoals in het begin is echter, is glas echter niet immuun voor alle stoffen: het reageert met de HF, zelfs verdund, hete alkalisten, zoals NaOH, en H3Po4 Zeer geconcentreerd en heet.
Kan u van dienst zijn: pyrolyseKunststoffen
 Als de pan van Teflon niet inert was, zou het al het voedsel bederven dat we erin hebben gekookt. Bron: MDEVICENTE, CC0, via Wikimedia Commons
Als de pan van Teflon niet inert was, zou het al het voedsel bederven dat we erin hebben gekookt. Bron: MDEVICENTE, CC0, via Wikimedia Commons Plastic vervult ook functies die vergelijkbaar zijn met die van glas, maar er zijn veel meer veelzijdig (ze breken niet zo gemakkelijk). Sommige kunststoffen, zoals teflon (polytetrluorethyleen), kynar (polyvinylideen fluoride) en teleen (polydiccyclopentadieen), zijn extreem resistent tegen de aanval van zuren en corrosie.
Keramiek
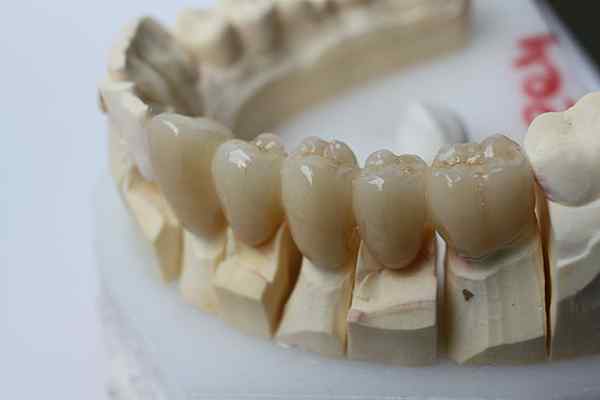 De chemische traagheid van de zirkonia maakt het mogelijk om te worden gebruikt voor tandheelkundige prothesen. Bron: Bin Im Garten via Wikipedia.
De chemische traagheid van de zirkonia maakt het mogelijk om te worden gebruikt voor tandheelkundige prothesen. Bron: Bin Im Garten via Wikipedia. Het inerte keramiek gaat nog een stap verder dan kunststoffen. Ze zijn bedoeld voor toepassingen waar hoge temperaturen overheersen, vrij gebruikelijk in de auto- en ruimtevaartindustrie; of in biochemische systemen, zoals in de farmaceutische industrie en bij de implementatie van botprothesen.
Onder sommige van deze keramiek met geweldige chemische traagheid hebben we: aluminiumoxide (2OF3, Aanwezig in de Corindon en Sapphire), de silicaten (gespecialiseerd glas), siliciumcarbide (sic, hard en vasthoudend) en zirkonia (zio2)).
Inerte gassen
De inerte materialen opzij laten, we hebben nu inerte stoffen. Inerte gassen zijn niet erg reactief, dus hun aanwezigheid in de lucht impliceert geen enkel risico op reactie onder normale omstandigheden.
Onder deze gassen hebben we de CO2, CO en n2. Stikstof is het meest inerte van al deze gassen; En toch is hij in staat om heet te reageren met sommige metalen om nituros te vormen, m3NN, wezen N Valencia of metaaloxidatietoestand.
De CO2 Het is relatief inert; Behalve wanneer het alkalische oplossingen voldoet, waar het wordt omgezet in carbonaten, of in aanwezigheid van kolenanhydraïde enzymen.
Van zijn kant blijft de CO inert bij kamertemperatuur; Maar bij hoge temperaturen reageert het met kolen, waterdamp, metaaloxiden, olefines, onder andere verbindingen.
Kan u van dienst zijn: chemisch evenwicht: uitleg, factoren, typen, voorbeeldenDergelijke reacties kunnen doorgaan in aanwezigheid van metaalkatalysatoren. Evenzo is CO, zelfs zonder zijn covalente bindingen te verbreken, in staat om neutrale metaalatomen te coördineren.
Nobele metalen
Nobele metalen zijn het meest resistent tegen corrosie en aanval van zuren en alkalisten. Elk, bij hoge temperaturen, of in stofformaat, reageert met zuurstof of fluoride. Daarom is de chemische traagheid van deze elementen behoorlijk relatief.
Onder de nobele metalen die we hebben: goud (au), ruthenio (ru), platina (pt), paladio (pd), osmio (os) en iridido (ir). Van allemaal is goud de edelste, zelfs in een metalen staat in de aardkorst.
Edelgassen
En ten slotte, in de hoogste zetel van chemische traagheid, hebben we nobele gassen: helium (hij), neon (ne), argon (ar), crypton (KR), Xenon (XE) en radon (RN). Ze zijn allemaal extreem inert. Veel verbindingen van de Xenon zijn echter gesynthetiseerd, waaronder zouten bekend als perxenatos, met de Xeo Anion64-.
 Neonlichten komen overeen met de meest inerte chemische elementen van de natuur
Neonlichten komen overeen met de meest inerte chemische elementen van de natuur De chemische traagheid is omdat hun atomen hun energie- en orbitale lagen volkomen vol met elektronen bevatten. Uit het argon is het mogelijk dat ze onder ultracessies toegang krijgen tot elektronen met behulp van lege orbitale of meer energielagen (bijvoorbeeld 3D en 4S); ding dat onmogelijk is voor helium of neon.
Van edelgassen precies helium en neon zijn de meest inert. Het helium is in staat om verbindingen te vormen met natrium tot zeer hoge druk (HENA).
Ondertussen is er helemaal geen verbinding bekend, nog meer inert dan helium zelf vanwege zijn grotere effectieve nucleaire belasting, die een atoom sterk afstoot dat neonatomen probeert te benaderen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Inorgán chemieICA. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Chemisch inert. Opgehaald uit: in.Wikipedia.borg
- Dr. Doug Stewart. (2020). Definitie van inert. Hersteld van: chemicool.com
- Elsevier B.V. (2020). Chemische inertie. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Clara Moskowitz. (20 maart 2018). Een edelgasverrassing: helium kan rare verbindingen vormen. Hersteld van: Scientific American.com
- Coorstek. (2020). Chemische eigenschappen van technisch keramiek. Hersteld van: Coorstek.com
- Osborne Industries. (2020). De 3 meest zuurbestendige kunststoffen. Hersteld van: OsborneIndustries.com

