Kwikhydroxidestructuur, eigenschappen, gebruik, risico's
- 4434
- 60
- Dr. Rickey Hudson
Hij Kwikhydroxide Het is een anorganische verbinding waarin het kwikmetaal (Hg) een oxidatienummer van 2 heeft+. De chemische formule is HG (OH)2. Deze soort is echter nog niet verkregen in vaste vorm onder normale omstandigheden.
Mercurius- of kwikhydroxidehydroxide is een tijdelijke intermediair met korte levensduur in de vorming van het HGO -kwikoxide in alkalische oplossing. Voor studies uitgevoerd in HGO Mercuricoxide -oplossingen is afgeleid dat Hg (OH)2 Het is een zwakke basis. Andere soorten die het vergezellen zijn HGOH+ en de HG2+.
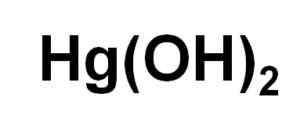 Chemische formule van kwikhydroxide (II). Auteur: Marilú Stea.
Chemische formule van kwikhydroxide (II). Auteur: Marilú Stea. Ondanks dat ze niet kunnen worden neergeslagen in waterige oplossing, de HG (OH)2 Het is verkregen door fotochemische reactie van kwik met waterstof en zuurstof bij zeer lage temperaturen. Het is ook verkregen in de vorm van een coprecipitated samen met het geloof (OH)3, waarbij de aanwezigheid van haluro -ionen invloed uitoefent op de pH waarin coprecipitatie optreedt.
Aangezien het niet gemakkelijk puur heeft verkregen op laboratoriumniveau, is het niet mogelijk geweest om een nut te vinden voor deze verbinding, of de risico's van het gebruik ervan te bepalen. Het kan echter worden afgeleid dat het dezelfde risico's oplevert als de andere kwikverbindingen.
[TOC]
Molecula -structuur
De structuur van kwikhydroxide (II) Hg (OH)2 Het is gebaseerd op een lineair centraal gedeelte gevormd door het kwikatoom met de twee zuurstofatomen aan de zijkanten.
De waterstofatomen zijn verenigd met deze centrale structuur, elk naast elke zuurstof, die vrij rond elke zuurstof draaien. Het kan op een eenvoudige manier worden weergegeven zoals hieronder aangegeven:
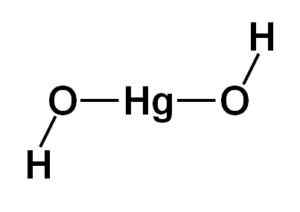 Theoretische structuur van kwikhydroxide (II). Auteur: Marilú Stea
Theoretische structuur van kwikhydroxide (II). Auteur: Marilú Stea Elektronische configuratie
De elektronische structuur van de metalen kwik Hg is als volgt:
[Xe] 5D10 6S2
waarbij [xe] de elektronische configuratie is van edelgas xenon.
Bij het observeren van deze elektronische structuur wordt afgeleid dat de meest stabiele oxidatietoestand van kwik degene is waar de 2 elektronen van laag 6 verloren gaanS.
In Hg (OH) Mercuric Hydroxide2, Mercury Atom (HG) wordt gevonden in zijn oxidatietoestand 2+. Daarom in de Hg (OH)2 Mercury heeft de volgende elektronische configuratie:
Het kan u van dienst zijn: 30 gebruik van carbonzuren in het dagelijks leven[Xe] 5D10
Nomenclatuur
- Kwikhydroxide (II)
- Kwikhydroxide
- Mercury dihydroxide
Eigenschappen
Molecuulgewicht
236.62 g/mol
Chemische eigenschappen
Volgens de geraadpleegde informatie is het mogelijk dat HG (OH)2 Een voorbijgaande verbinding zijn in de vorming van HGO in alkalisch waterig medium.
De toevoeging van hydroxylionen (oh-) naar een waterige oplossing met kwikionen Hg2+ Het leidt tot de neerslag van een gele vaste kwikoxide (ii) HGO, waarvan Hg (OH)2 Het is een passagier of tijdelijke agent.
 Kwikoxide (ii). Leiem [cc by-sa 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons.
Kwikoxide (ii). Leiem [cc by-sa 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons. In waterige oplossing de HG (OH)2 Het is een tussenliggende intermediaire levensduur, omdat het snel een watermolecuul vrijgeeft en de vaste HGO neerslaat.
Hoewel het niet mogelijk is geweest om de Mercuric Hydroxide Hg (OH) neer te slaan2, Kwikoxide (II) HGO is iets oplosbaars in water dat een oplossing vormt van soorten genaamd "Hydroxides".
Deze soorten in water genaamd "hydroxiden" zijn zwakke bases en, hoewel ze zich soms gedragen als amfotoraten, in het algemeen de HG (OH)2 Het is meer eenvoudig dan zuur.
Wanneer de HGO oplost in HCLO4 Studies geven de aanwezigheid van kwikionen Hg aan2+, Een HGOH monohydroximercuro ion+ en Hg (OH) Mercuric Hydroxide2.
De saldi die zich voordoen in dergelijke waterige oplossingen zijn de volgende:
Hg2+ + H2Of ⇔ hgoh+ + H+
HGOH+ + H2Of ⇔ Hg (oh)2 + H+
In NaOH -alkalische oplossingen wordt de soort Hg (OH) gevormd3-.
Het verkrijgen van
Pure kwikhydroxide
Kwikhydroxide (ii) Hg (OH)2 Het kan niet worden verkregen in waterige oplossing, omdat door alkali toe te voegen aan een oplossing van HG -handelaarsionen2+, het gele kwikoxide neerslaan.
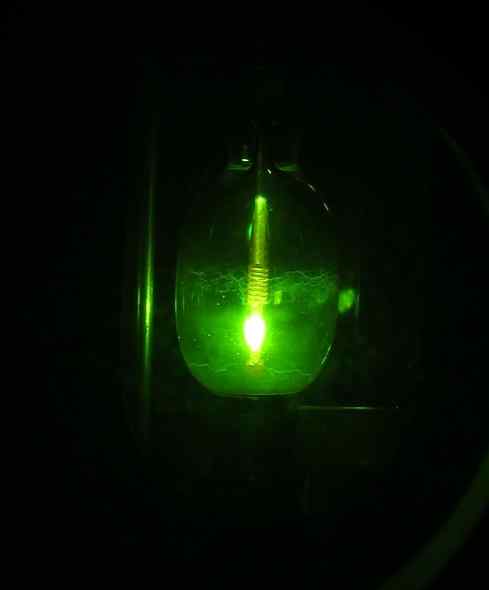
Sommige onderzoekers slaagden er echter in om in 2005 voor het eerst de Hg (OH) Mercuric Hydroxide te verkrijgen2 met behulp van een kwikbooglamp, beginnend bij het kwikhg -element, waterstof h2 en zuurstof of2.
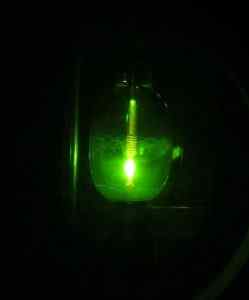 Kwiklamp. D-Kuru [CC BY-SA 2.0 op (https: // creativeCommons.Org/licenties/by-sa/2.0/bij/akte.in)]. Bron: Wikipedia Commons.
Kwiklamp. D-Kuru [CC BY-SA 2.0 op (https: // creativeCommons.Org/licenties/by-sa/2.0/bij/akte.in)]. Bron: Wikipedia Commons. De reactie is fotochemisch en werd uitgevoerd in aanwezigheid van neon, argon of vast deuterium bij zeer lage temperaturen (ongeveer 5 k = 5 graden kelvin). Het bewijs van de samengestelde vorming werd verkregen door IR -lichtabsorptiespectra (infrarood).
Kan u van dienst zijn: neerslaanDe HG (OH)2 Op deze manier voorbereid is zeer stabiel onder de omstandigheden van ervaring. Geschat wordt dat de fotochemische reactie door de O-HG-O-intermediair verloopt naar het stabiele molecuul H-O-HG-O-H.
Coprecipitatie met ijzerhydroxide (III)
Als kwiksulfaat (ii) hgso oplost4 en ijzersulfaat (iii) geloof2(SW4))3 In zure waterige oplossing, en de pH begint te worden verhoogd door een NaOH -natriumhydroxide -oplossing toe te voegen, is na een rusttijd een vaste stof die wordt gevormd een coprecipiteerde Hg (OH)2 en geloof (oh)3.
Het is gebleken dat de vorming van Hg (OH)2 Het is een cruciale stap in deze coprecipitatie met geloof (oh)3.
De vorming van Hg (OH)2 In het neerslag geloof (oh)3-HG (OH)2 Het hangt sterk af van de aanwezigheid van ionen zoals fluoride, chloride of bromide, van de specifieke concentratie van deze en de pH van de oplossing.
In aanwezigheid van fluoride (f-), Een pH groter dan 5, de coprecipitatie van Hg (OH)2 Met geloof (oh)3 wordt niet beïnvloed. Maar tot een pH van 4 de vorming van complexen tussen de Hg2+ en f- interfereert in de coprecipitatie van Hg (OH)2.
In het geval van de aanwezigheid van chloride (CL-), Coprecipitation of Hg (OH)2 Het komt voor een pH van 7 of groter, dat wil zeggen bij voorkeur in alkalisch medium.
Wanneer de bromide aanwezig is (Br-), Coprecipitation of Hg (OH)2 Het verschijnt bij een nog grotere pH, dat wil zeggen pH boven 8,5 of meer alkalisch dan met chloride.
Toepassingen
Uit de beoordeling van de beschikbare informatiebronnen volgt hieruit dat Mercury Hydroxide (II) Hg (OH)2, Als een verbinding die nog niet commercieel is voorbereid, heeft het geen bekende toepassingen.
Recent onderzoek
Via computationele simulatietechnieken in 2013 werden de structurele en energiekenmerken gerelateerd aan Hg (OH) hydratatie bestudeerd2 In een gasvormige staat.
Metaal-ligando-coördinatie en solvatie-energieën werden berekend en vergeleken door de mate van Hg (OH) hydratatie te variëren2.
Onder andere bleek dat blijkbaar de theoretische oxidatietoestand 1+ is in plaats van het vermeende 2+ dat meestal is toegewezen voor HG (OH)2.
Kan u van dienst zijn: theoretische prestatiesRisico's
Hoewel de HG (OH)2 Als zodanig is niet in voldoende kwantel geïsoleerd.
Het kan giftig zijn voor het zenuwstelsel, het spijsverteringssysteem, de huid, de ogen, de luchtwegen en de nieren.
De inhalatie, inname of contact met de huid van kwikverbindingen kan schade veroorzaken, variërend van de irritatie van ogen en huid, slapeloosheid, hoofdpijn, tremoren, schade aan het darmkanaal, geheugenverlies, tot nierinsufficiëntie, tussen andere symptomen.
Mercurius is internationaal erkend als een verontreinigende stof. De meeste kwikverbindingen die in contact komen met de omgeving worden gemethyleerd door de bacteriën die aanwezig zijn in bodems en sedimenten, waardoor methylkwik wordt gevormd.
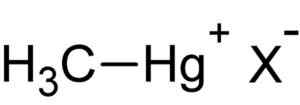 Methylmercury hal. Auteur: geüpload door gebruiker: Rifleman 82. Bron: Onbekend. Bron: Wikipedia Commons.
Methylmercury hal. Auteur: geüpload door gebruiker: Rifleman 82. Bron: Onbekend. Bron: Wikipedia Commons. Deze verbinding is bioaccumula in levende organismen, van de grond naar de planten en van daar naar de dieren gaan. In de aquatische omgeving is de overdracht nog sneller, die in korte tijd van zeer kleine soorten naar het grote gaat.
Methylmercury heeft een giftig effect voor levende wezens en met name voor de mens, die het door de voedselketen innam.
Wanneer ingenomen met voedsel is vooral schadelijk voor jonge kinderen en foetussen bij zwangere vrouwen, omdat een neurotoxine zijn schade en zenuwstelsel in vorming en groei kan veroorzaken.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Wang, Xuefeng en Andrews, Lester (2005). Infraroodspectrum van Hg (OH)2 In solide neon en argon. Anorganic Chemistry, 2005, 44, 108-113. Hersteld van pubs.ACS.borg.
- Amaro-Estrada, J.Je., et al. (2013). Waterige oplossing van Hg (OH)2: Energetische en dynamische dichtheid Functionele theoriestudies van de Hg (OH)2-(H2OF)N (N = 1-24) structuren. J. Fysiek. Chem. Tot 2013, 117, 9069-9075. Hersteld van pubs.ACS.borg.
- Inoue, Yoshikazu en Munemori, Makoto. (1979). Coprecipitatie van kwik (II) met ijzer (III) hydroxide. Milieuwetenschap en technologie. Deel 13, nummer 4, april 1979. Hersteld van pubs.ACS.borg.
- Chang, L.W., et al. (2010). Zenuwstelsel en gedragstoxicologie. Bij het begrijpen van toxicologie. Hersteld van Scientedirect.com.
- Haney, Alan en Lipsey, Richard L. (1973). Accumulatie en effecten van methylkwikhydroxide in een terrestrariële voedselketen onder laboratoriumcondies. Omgeving. Vervuiling. (5) (1973) PP. 305-316. Hersteld van Scientedirect.com.
- « Flavin adenin dinucleotide (FAD) kenmerken, biosynthese
- Glyceraldehyde 3-fosfaat (G3P) structuur, functies »

