Magnesiumhydroxidestructuur, eigenschappen, nomenclatuur, gebruik

- 2062
- 466
- Cecil Graham
Hij magnesium hydroxide Het is een anorganische verbinding waarvan de chemische formule Mg is (OH)2. In zijn pure vorm is het een witte vaste stof zonder helderheid en amorf uiterlijk; Met een klein en nauwkeurig gehalte aan onzuiverheden wordt het echter omgezet in de kristallijne vaste brucita, een mineraal dat zich in bepaalde afzettingen in de natuur bevindt en een rijke bron van magnesium is.
Het is een zwakke elektrolyt of basis, dus de dissociatie ervan is weinig water. Deze eigenschap maakt de mg (oh)2 een goede zuurgraadneutralisatie voor menselijke consumptie; In de volksmond bekende remedie als de ophanging van melk uit Magnesia. Het is ook een brandvertrager door water vrij te geven tijdens zijn thermische ontleding.
 Vast magnesiumhydroxidemonster. Bron: ChemicalInterest [Public Domain]
Vast magnesiumhydroxidemonster. Bron: ChemicalInterest [Public Domain] In het bovenste beeld worden sommige vaste stoffen van magnesiumhydroxide getoond, waarin de ondoorzichtige witte kleur te zien is. Hoe meer kristallijn ze zijn, ze ontwikkelen glazige en pareloppervlakken.
De kristallijne structuur is eigenaardig, omdat het dubbele lagen zeshoekige kristallen vaststelt, die veelbelovende ontwerpen zijn voor het ontwerp van nieuwe materialen. In deze lagen spelen hun positieve belastingen een belangrijke rol vanwege de vervanging van de MG2+ door driede kationen, en tot de soort die beperkt zijn tussen de muren die zijn samengesteld uit oh anionen-.
Aan de andere kant leiden andere toepassingen af van de morfologie van bereide deeltjes of nanodeeltjes; als katalysatoren of adsorbentia. In allemaal is de 1: 2 -verhouding voor mg -ionen constant2+: Oh-, weerspiegeld in dezelfde MG -formule (OH)2.
[TOC]
Structuur
Formule en octaedro
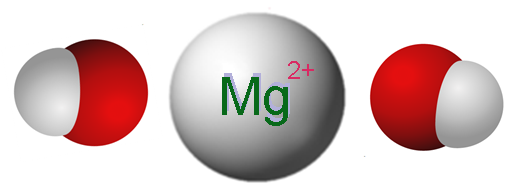 Ionen die magnesiumhydroxide vormen. Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Ionen die magnesiumhydroxide vormen. Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] De superieure afbeelding toont de ionen die de mg vormen (oh)2. Zoals te zien is, zijn er twee anionen oh- Voor elk kation mg2+, die elektrostatisch interageren om een zeshoekige structuurkristal te definiëren. Dezelfde formule geeft aan dat de MG -verhouding: OH is 1: 2.
De ware kristallijne structuur is echter een beetje ingewikkelder dan om eenvoudige mg -ionen aan te nemen2+ en oh-. Eigenlijk wordt magnesium gekenmerkt door een coördinatienummer van 6 te hebben, dus het kan interageren met maximaal zes oh-.
Zo wordt de octaëder mg (OH) gevormd6, waar zuurstofatomen duidelijk voortkomen uit oh-; en de kristallijne structuur berust nu op de afweging van dergelijke octaëder en hoe ze met elkaar omgaan.
In feite, mg (oh) eenheden6 Ze definiëren uiteindelijk dubbele lagen structuren die op hun beurt in de ruimte worden besteld om het zeshoekige glas te veroorzaken.
Kan u van dienst zijn: atoomgewichtDubbele laag
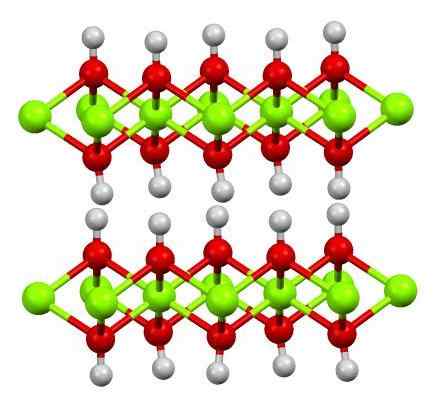 Dubbele laag magnesiumhydroxide. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Dubbele laag magnesiumhydroxide. Bron: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] De bovenste afbeelding toont de dubbele laag magnesiumhydroxide (LDH) Gelaagde dubbele hydroxiden)). Groene bollen vertegenwoordigen mg -ionen2+, die kunnen worden vervangen door anderen met een grotere belasting om een positieve belasting in de laag te genereren.
Merk op dat rond elke Mg2+ Er zijn zes rode bollen verbonden met hun respectieve witte bollen; dat wil zeggen, de octaëdrische eenheden mg (oh)6. OH- Het fungeert als een brug om zich bij twee mg aan te sluiten2+ van verschillende vliegtuigen, waardoor de lagen worden beperkt.
Evenzo wordt waargenomen dat waterstofatomen omhoog en omlaag wijzen en de eerste zijn die verantwoordelijk zijn voor intermoleculaire krachten om de twee lagen Mg (OH) eenheden bij elkaar te houden6.
Onder deze lagen, neutrale moleculen (zoals alcoholen, ammoniak en stikstof) of zelfs anionen, afhankelijk van hoe positief ze zijn (als er ionen zijn3+ of geloof3+ De MG vervangen2+)). De "vulling" van deze soorten wordt beperkt door de oppervlakken bestaande uit oh anionen-.
Morfologie
Het zeshoekige en dubbele lagen glas groeit langzaam of snel. Het hangt allemaal af van de synthese- of bereidingsparameters: temperatuur, molaire relatie, agitatie, oplosmiddelen, reagentia als een bron van magnesium, basen of neerslagmiddelen, enz. Naarmate het glas groeit, definieert u de microstructuur of morfologie van zijn nanodeeltjes of aggregaten.
Deze nanodeeltjes kunnen dus gerechten, bloedplaatjes of bloemkool hebben. Evenzo kan de verdeling van zijn grootte veranderen, evenals de mate van porositeit van de resulterende vaste stoffen.
Eigenschappen
Fysiek uiterlijk
Het is een witte, gegranuleerde of gepoederde vaste stof en toilet.
Molaire massa
58,3197 g/mol.
Dikte
3,47 g/ml.
Smeltpunt
350 ºC. Bij deze temperatuur breekt het af in het oxide door de watermoleculen in hun kristallen vrij te geven:
Mg (oh)2(s) => mgo (s) +h2O (g)
Oplosbaarheid in water
0,004 g/100 ml bij 100 ° C; Dat wil zeggen, het slaagt er nauwelijks in om op te lossen in kokend water, dus het is een onoplosbare verbinding in water. Door de pH (of toenemende zuurgraad) te verlagen, wordt de oplosbaarheid echter verhoogd door de vorming van de complexe ACUO, MG (OH2))6.
Aan de andere kant, als de mg (oh)2 heeft CO geabsorbeerd2, zal het gas vrijgeven dat als bruisen is bij oplossen in een zuur medium.
Kan u van dienst zijn: helium: geschiedenis, eigenschappen, structuur, risico's, gebruikBrekingsindex
1.559
pH
Een waterige ophanging ervan heeft een pH die varieert tussen 9,5 en 10,5. Hoewel deze waarden normaal zijn, weerspiegelt het zijn kleine basiciteit tegen andere metaalhydroxiden (zoals NaOH).
Warmte capaciteit
77.03 J/Mol · K
Waar bevindt het zich?
 Blue Brucita Blue Blut. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Blue Brucita Blue Blut. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Magnesiumhydroxide kan in de natuur worden gevonden als het Brucita -mineraal, dat wordt gekenmerkt door zijn transparante witte kleur, met groene of blauwachtige tonen, afhankelijk van de onzuiverheden. Evenzo maakt de Brucita deel uit van sommige klei, zoals chloriet, wanneer u tussen de lagen silicaten aftast, verbonden door metaalionen.
In La Brucita zijn er andere ionen naast MG2+, zoals al3+, Vertrouwen3+, Zn2+ en Mn2+. Hun mena's zijn te vinden in verschillende regio's of meren van Schotland, Canada, Italië en de VS.
Fysiek zien hun kristallen.
Dit mineraal is een van de kwaden die cement en beton beïnvloeden, omdat het de neiging heeft zich uit te breiden en fracturen erin te veroorzaken. Het absorbeert echter niet CO2, De calcinatie ervan draagt dus niet bij aan het broeikaseffect en daarom is het een geschikte mineralogische bron (en de rijkste) om magnesium te verkrijgen, naast zeewater.
Nomenclatuur
De MG (OH)2 Het heeft maximaal drie namen geaccepteerd door de IUPAC (uit mineralogie of geneeskunde). Deze lijken erg op elkaar op, want net als de manier waarop ze eindigen.
De 'magnesiumhydroxide' komt bijvoorbeeld overeen met zijn naam volgens de voorraadnomenclatuur, waardoor de (ii) aan het einde wordt weggelaten omdat de +2 bijna standaard de enige oxidatietoestand van de magnesium is.
'Magnesium dihydroxide', wijzend met het Griekse teller prefix het aantal OH -ionen- aangegeven in de formule volgens de systematische nomenclatuur. En 'magnetische hydroxide', eindigend met het achtervoegsel -ICO als de maximale en "unieke" staat van oxidatie van magnesium, volgens de traditionele nomenclatuur.
De andere namen, zoals Brucita of Magnesia Milk, hoewel ze direct gerelateerd zijn aan deze verbinding, is het niet handig om ernaar te verwijzen als het gaat om zijn puurste vaste stof, of als een anorganische verbinding (reagens, grondstof, enz.)).
Toepassingen
Neutralizer
De MG (OH)2 Vanwege de lage oplosbaarheid in water is het feit dat het een uitstekende zuurgraadneutralisatie is; Anders zou het medium baseren bij het bijdragen van grote concentraties OH -ionen-, zoals andere bases (sterke elektrolyten) doen.
Kan u van dienst zijn: chemische hybridisatieDus de mg (oh)2 Breng nauwelijks oh los-, Tegelijkertijd reageert het met H -ionen3OF+ Om het magnesiumcomplex te vormen, ook hierboven genoemd. In staat zijn om de zuurgraad van waterige media te neutraliseren, is het bestemd voor de behandeling van afvalwater.
Het is ook een additief van voedsel, meststoffen en bepaalde persoonlijke hygiëneproducten, zoals tandpasta, omdat de zuurgraad afneemt.
Antacida
Omdat het weinig in water oplosbaar is, kan het worden genomen zonder het risico te lopen op de effecten van zijn OH -ionen- (heel weinig dissocieert zoals zwakke elektrolyt).
Dit kenmerk, gekoppeld aan het subdeel van bovenaf, maakt het een antacida om de zuurgraad, gastro -intestinale ziekten, indigestie en constipatie te behandelen, verkocht onder de formule van magnesia -melk.
Aan de andere kant helpt de melk van Magnesia ook om de vervelende facies te bestrijden (de witte en rode zweren die in de mond verschijnen).
Brandweer
In het gedeelte Eigenschappen werd vermeld dat de MG (OH)2 Het breekt af te lossen water. Precies, dergelijk water helpt de voortgang van de vlammen te stoppen, omdat ze warmte absorberen om te verdampen en op hun beurt de dampen verbrandbare of ontvlambare gassen verdunnen.
Het Brucita -mineraal wordt meestal industrieel gebruikt voor dit doel, bedoeld als het invullen van bepaalde materialen, zoals kunststoffen van verschillende polymeren (PVC, harsen, rubbers), kabels of plafonds.
Katalysator
De MG (OH)2 gesynthetiseerd als nanoplaquetas is gebleken dat efficiënt is om chemische reducties te katalyseren; Bijvoorbeeld de 4-nitrofenol (ph-no2) Een 4-aminofenol (pH-NH2)). Ze hebben ook antibacteriële activiteit, dus het kan worden gebruikt als een therapeutisch middel.
Adsorbens
Sommige mg (oh) vaste stoffen2 Ze kunnen behoorlijk poreus zijn, afhankelijk van de methode van hun voorbereiding. Daarom vinden ze toepassing als adsorbentia.
In waterige oplossingen kunnen ze de kleurmoleculen adsorberen (op hun oppervlakken), waardoor het water wordt verduidelijkt. Ze kunnen bijvoorbeeld de indigo -karminekleurstof adsorberen die aanwezig is in waterstromen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Hydroxide magnesium. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Hydroxide magnesium. PubChem -database. CID = 14791. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Amethist -galerijen. (2014). De minerale bruciet. Hersteld van: galerijen.com
- Henrist et al. (2003). Morfologische studie van magnesiumhydroxide nanodeeltjes
- overgebracht in verdunde waterige oplossing. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Synthese en structurele analyse van mesoporeuze magnesiumhydroxide nanodeeltjes als efficiënte katalysator.
- Thimmasandra Narayan Ramesh en Vani Pavada Sreenivasa. (2015). Verwijdering van Indigo Carmine Dye uit waterige oplossing met behulp van magnesiumhydroxide als adsorbens. Journal of Materials, Vol. 2015, artikel ID 753057, 10 pagina's. doen.org/10.1155/2015/753057
- « Nikkelgeschiedenis, eigenschappen, structuur, gebruik, risico's
- Carlos Pellicer Chamber Biography, Style, Works, Frases »

