Chlooroxide (III) eigenschappen, structuur, gebruik
- 1223
- 50
- Miss Herman Russel
Hij chlooroxide (III) Het is een anorganische verbinding waarvan de chemische formule Cl is2OF3. Komt overeen met het anhydride van chloorzuur, HCLO2. Het is een donkerbruine vaste, zeer explosief, zelfs bij temperaturen onder 0ºC, en slecht gekarakteriseerd. Daarom is het onderhevig aan interesse voor computerstudies.
Chemisch is het een covalent oxide, dus er zijn Cl-O-bindingen en een discreet molecuul van CL2OF3 (lagere afbeelding). Dit molecuul kan de HCLO uitdrogen2, of door het aan lage temperaturen te onderwerpen. Het detail is dat het de productie van CL ontleedt2, OF2, of andere thermodynamisch stabielere chlooroxiden.
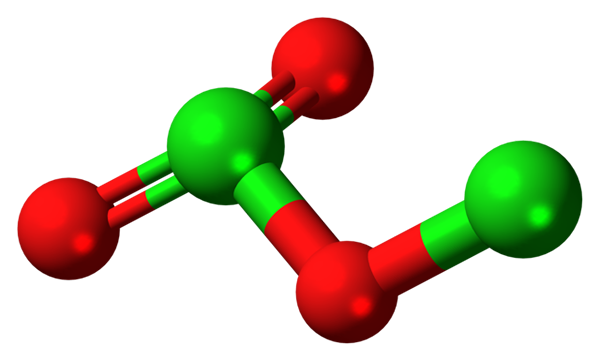
 Dicloro -trioxidemolecuul. Bron: Jynto [CC0].
Dicloro -trioxidemolecuul. Bron: Jynto [CC0]. Omdat de Cl-O-obligaties weinig polair zijn, de CL-e-mail2OF3 Het heeft een klein dipoolmoment; Daarom lost het niet goed op in water of interageert het met andere polaire oplosmiddelen. De instabiliteit is zodanig dat het geen bekend commercieel of potentieel gebruik is (of als een explosief zou de toepasbaarheid levensvatbaar zijn).
De belangrijkste reden voor de instabiliteit kan te wijten zijn aan de elektronische kenmerken van de vermeende CL3+ (uitgaande van een puur ionisch karakter). In feite zijn de oxidatie +1 en +5 toestanden het meest stabiel wanneer chloor verbindingen vormt met zuurstof.
[TOC]
Eigenschappen
Omdat de karakterisering slecht is en niet gedocumenteerd is, is er niet veel te zeggen over de eigenschappen behalve de volgende punten:
-Het heeft een moleculaire massa van 118.903.
-Het is een solide donkerbruin; Hoewel je gasvormige chloor kunt sublimeren en gelige groene dampen zeggen.
-Het mist zowel kokend als fusiepunt, omdat het bij 0ºC explodeert (en ook bij koudere temperaturen).
Kan u van dienst zijn: dihydroxyacetonfosfaat (DHAP): kenmerken en toepassingen-De oplosbaarheid in water wordt geschat op ongeveer 3,42 g/100 ml, wat bewijst dat het een covalente molecuul van lage polariteit is.
-Reageert met water (het weinige dat oplost) om de HCLO te worden2:
Klet2OF3 + H2Of 2hclo2
Chlooroxidestructuur (III)
In het beeld werd de moleculaire structuur van de CL getoond2OF3 Met een bollen en barsmodel. Hoewel het niet het blote oog lijkt, zijn de stilzwijgende implicaties van hun ruimtelijke banden en regelingen ingewikkelder dan ze verschijnen. Deze structuur komt overeen met een van de vele mogelijke isomeren voor deze verbinding.
De rode bollen komen overeen met zuurstofatomen en de groene met chlooratomen. Het chloor aan de linkerkant presenteert trigonale piramide -geometrie, met een paar vrije elektronen; Dus kan worden aangenomen dat uw hybridisatie SP moet zijn3. Een zuurstofatoom fungeert als een brug tussen de twee chloors, cl-o-cl.
Isomeren
Wat zijn de andere isomeren? In theorie worden negen berekend, waarvan vier het meest stabiel zijn (inclusief de afbeelding). De andere drie zouden structuren hebben zoals:
-Clclo3. Zeer vergelijkbaar met die van het uitgelegd, maar met een Cl-Cl-link.
-CLOOOCL (1). In dit isomeer is er een brug van drie zuurstof die de twee chlooratomen scheiden (onthoud de hoekgeometrie van H2Of om het te visualiseren).
-CLOOOCL (2). Dezelfde geoxygeneerde brug is ook aanwezig in dit isomeer, met uitzondering van de twee chlooratomen zijn overschaduwd in de ruimte; de ene voor de andere, terwijl ze in het vorige isomeer ver weg zijn.
Het kan u van dienst zijn: AlquinosNomenclatuur
De naam, chlooroxide (III), komt overeen met de toegewezen volgens de voorraadnomenclatuur. Hier wordt aangenomen dat chloor een oxidatietoestand van +3 heeft; Maar het betekent niet dat het Cl -kation3+ kan aanwezig zijn. Het is een molecuul, geen ionennetwerk.
Een andere naam waarmee de CL ook bekend is2OF3 Het is dicloro -trioxide, volgens de systematische nomenclatuur.
En laatste. Deze naam is te wijten aan het feit dat, zoals reeds uitgelegd, de CL2OF3 Het gebeurt wanneer de HCLO2 Het condenseert water water.
Toepassingen
Omdat het een chlooroxide is, het meest onmiddellijke gebruik dat voor de CL kan worden gedacht2OF3 Het is als een oxidatiemiddel, in staat om organische onzuiverheden en microben te neutraliseren. Het is echter zeer onstabiel, naast explosief, zodat het voor dit doel nuttig wordt geacht.
Er is zeker geen informatie, zelfs niet hoe de CL zich zou gedragen2OF3 Onder enorme druk (als het niet in het proces explodeert). Onder normale omstandigheden lijkt het niets meer te zijn dan een relatief stabiele en differentiële tussenpersoon, naast andere stabielere chlooroxiden.
Computationeel is het echter onderworpen aan bestuderen om mechanismen te bepalen door vrije radicalen waarbij verschillende soorten chloor en zuurstof betrokken zijn.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Trioxide dichloor. Opgehaald uit: in.Wikipedia.borg
- Geef hem l. Perry. (2011). Handboek van anorganische verbindingen. (Tweede druk). CRC Press Taylor & Francis Group.
- Richard C. Roppen. (2013). Encyclopedie van de alkalische aarde -verbindingen. Elsevier.
- Kim K. H., Han en.K., en lees en. S. (1999). Basis Set Effecten op de stabiliteit van de CL2O3 -isomeren met behulp van B3P86- en B3LYP -methoden van Dichtheid Functionele theorie. Journal of Molecular Structure Theochem 460 (1-3): 19-25.
- « IJzerhydroxide (II) structuur, eigenschappen, gebruik
- Tetrodotoxinestructuur, kenmerken, gebruik, effecten »

