Heptano (C7H16) structuur, eigenschappen en gebruik
- 3610
- 854
- Aaron Okuneva
Hij heptano Het is een organische verbinding waarvan de chemische formule c is7H16 en bestaat uit negen structurele isomeren, waarvan de bekendste de lineaire is. Het is een koolwaterstof, met name een alkaan of paraffine, die zich in de meeste organische chemielaboratoria bevindt, of het nu gaat om lesgeven of onderzoek.
In tegenstelling tot andere paraffinische oplosmiddelen, heeft de Heptano een lagere volatiliteit, die het relatief veiliger gebruik maakt; Wanneer er geen warmtebron rond je dampen is en deze wordt gewerkt in een extractorbel. Het laat zijn ontvlambaarheid opzij, het is een voldoende inerte verbinding om te dienen als een middel voor organische reacties.
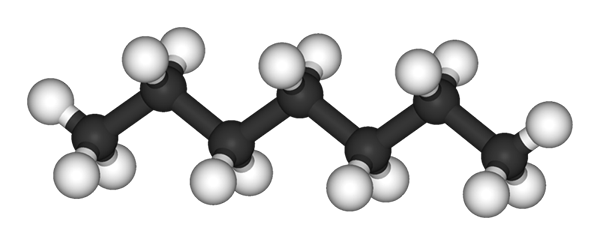
 N-HEPTANO MOLECULE GEREGAADD DOOR EEN MODEL VAN BRIJEN EN BARS. Bron: Ben Mills en Jynto [Public Domain]
N-HEPTANO MOLECULE GEREGAADD DOOR EEN MODEL VAN BRIJEN EN BARS. Bron: Ben Mills en Jynto [Public Domain] In de bovenste afbeelding heb je de structuur van de N-heptano, de lineaire isomeer van alle heptans. Omdat het de meest voorkomende isomeer is en van een grotere commerciële waarde, evenals het gemakkelijkst te synthetiseren, is het meestal aan het einde dat de term 'heptano' exclusief verwijst naar N-heptano; tenzij anders aangegeven.
In de flessen van deze vloeibare verbinding wordt echter gespecificeerd dat het bevat N-heptano. Ze moeten in een extractorbel blootleggen en de metingen zorgvuldig uitvoeren.
Het is een uitstekend oplosmiddel voor vetten en oliën, dus het wordt vaak gebruikt tijdens plantenessenties of andere natuurlijke producten.
[TOC]
Structuur
N-heptaan en zijn intermoleculaire interacties
Zoals te zien is in het eerste beeld, het molecuul van N-Heptano is lineair en vanwege de chemische hybridisatie van zijn koolstofatomen neemt de keten een zigzagueada -vorm aan. Dit molecuul is dynamisch, omdat de C-C-bindingen kunnen roteren, waardoor de ketting iets onder verschillende hoeken kan worden gevouwen. Dit draagt bij aan zijn intermoleculaire interacties.
Het kan u van dienst zijn: PI LinkHij N-Heptano is een apolair, hydrofobe molecuul en daarom zijn de interacties gebaseerd op de dispersieve krachten van Londen; Dit zijn degenen die afhankelijk zijn van de moleculaire massa van de verbinding en het contactgebied. Twee moleculen van N-Heptan.
Deze interacties zijn effectief genoeg om de moleculen van te handhaven N-Heptano -samenhangende in een vloeistof die kookt op 98 ºC.
Isomeren
 De negen isomeren van Heptan. Bron: Steffen 962 [Public Domain]
De negen isomeren van Heptan. Bron: Steffen 962 [Public Domain] In het begin werd gezegd dat Formule C7H16 vertegenwoordigde in totaal negen structurele isomeren, zijnde de N-heptane de meest relevante (1). De andere acht isomeren worden weergegeven in de bovenste afbeelding. Let op met het blote oog dat sommige meer vertakt zijn dan andere. Van links naar rechts, beginnend van bovenaf, hebben we:
(2): 2-methylhexan
(3): 3-methylhexan, dat bestaat uit een paar enantiomeren (A en B)
(4): 2,2-dimethylpentano, ook bekend als neoheptano
(5): 2,3-dimethylpentano, opnieuw met een paar enantiomeren
(6): 2,4-dimethylpentano
(7): 3.3-dimethylpentano
(8): 3-ethylpentaan
(9): 2,2,3-trimethylbutaan.
Elk van deze isomeren heeft onafhankelijke eigenschappen en toepassingen van de N-Heptano, meer dan wat dan ook gereserveerd voor organische synthesegebieden.
Hepthane -eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof met een geur vergelijkbaar met benzine.
Molaire massa
100,205 g/mol
Smeltpunt
-90.549 ºC, een moleculair kristal worden.
Kookpunt
98.38 ºC.
Dampdruk
52.60 atm bij 20 ºC. Merk op hoe hoog uw dampdruk is, ondanks dat het minder vluchtig is dan andere paraffinische oplosmiddelen, zoals Hexano en Pentan.
Dikte
0,6795 g/cm3. Aan de andere kant zijn heptano -dampen 3,45 keer dicht dan lucht, wat betekent dat hun dampen in de ruimtes zullen duren waar een beetje lekkage van hun vloeistof.
Kan u van dienst zijn: mierenzuur (hcooh)Oplosbaarheid in water
De heptaan voor een hydrofobe verbinding kan nauwelijks oplossen in het water om een oplossing te veroorzaken met een concentratie van 0,0003% bij een temperatuur van 20 ºC.
Oplosbaarheid in andere oplosmiddelen
Hepthane is mengbaar met koolstoftetrachloride, ethanol, aceton, oliether en chloroform.
Brekingsindex (ND))
1.3855.
Smurrie
0.389 MPA · S
Warmte capaciteit
224.64 J/K · mol
ontstekingspunt
-4 ºC
Zelf -richtingtemperatuur
223 ºC
Oppervlaktespanning
19.66 mn/m A 25 ºC
Verbranding warmte
4817 kJ/mol.
Reactiviteit
Hepthaandampen wanneer ze dicht bij een warmtebron (een vlam) zijn, reageren exotherme en krachtig met de zuurstof van de lucht:
C7H16 + 11o2 => 7co2 + 8h2OF
Buiten de verbrandingsreactie is heptaan echter een vrij stabiele vloeistof. Het gebrek aan reactiviteit is te wijten aan het feit dat hun C-H-banden moeilijk te breken zijn, dus het is niet vatbaar voor substituties. Het is ook niet erg gevoelig voor sterke oxidatiemiddelen, op voorwaarde dat er geen brand is in de buurt.
Het grootste gevaar van Heptano wordt vertegenwoordigd door zijn hoge volatiliteit en ontvlambaarheid, dus er is een brandrisico als het op hete locaties wordt gemorst.
Toepassingen
Oplosmiddel en een half reactie
 Hepthane is een uitstekend oplosmiddel om oliën en vetten op te lossen. Bron: Pxhere.
Hepthane is een uitstekend oplosmiddel om oliën en vetten op te lossen. Bron: Pxhere. Het hydrofobe karakter van Heptano is een uitstekend oplosmiddel om oliën en vetten op te lossen. In dit aspect is het gebruikt als een ontvangst. De grootste toepassing ervan ligt echter in gebruik als een extractor -oplosmiddel, omdat het de lipidecomponenten oplost, evenals de andere organische verbindingen van een monster.
Als u bijvoorbeeld alle componenten van gemalen koffie wilt extraheren, zou dit in heptaan worden gemacereerd in plaats van water. Deze methode en de variaties ervan zijn geïmplementeerd met alle soorten zaden, dankzij welke planten essenties en andere natuurlijke producten zijn verkregen.
Het kan u van dienst zijn: Unitary Cell: eigenschappen, rode constanten en typenDe heptaan, die van nature kleurloos is, zal worden geverfd door de kleur van de geëxtraheerde olie. Dan wordt dit gedraaid om eindelijk een volume van de olie zo puur mogelijk te hebben.
Aan de andere kant stelt de kleine reactiviteit van het heptaan ook in staat om een optie te zijn bij het overwegen van een manier van reactie om een synthese uit te voeren. Als een goed oplosmiddel van organische verbindingen, garandeert het dat de reagentia in oplossing blijven en met elkaar communiceren terwijl ze reageren.
Neerslagmiddel
In de oliechemie is het een gebruikelijke praktijk om asfaltens van een ruw monster te verslaan door Heptano toe te voegen. Deze methode maakt het mogelijk om de stabiliteit van verschillende ruwe te bestuderen en te bepalen hoe vatbaar zijn asfaltene -gehalte is om een hele reeks problemen voor de olie -industrie te verslaan en te dragen.
Octaan
De Heptan is gebruikt als brandstof vanwege de grote hoeveelheid warmte die het biedt wanneer hij brandt. Wat automotoren betreft, zou het echter schadelijk zijn voor de werking ervan als het puur zou worden gebruikt. Omdat het zeer explosief brandt, dient het om de 0 te definiëren op de octaanschaal van benzine.
Benzine bevat een hoog percentage heptano en andere koolwaterstoffen om octaan te nivelleren tot bekende waarden (91, 95, 87, 89, enz.)).
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Heptaan. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Heptane Pubchem -database. CID = 8900. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Elsevier B.V. (2020). Heptans. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Bell Chem Corp. (7 september 2018). Industrieel gebruik van heptaan. Hersteld van: Bellchem.com
- Andrea Kropp. (2020). Heptane: structuur, gebruik en formule. Studie. Hersteld van: studie.com
- « Gecondenseerde formule wat is en voorbeelden (methaan, ethaan, glucose ...)
- Mechanische energieformules, concept, typen, voorbeelden, oefeningen »

