Lewis structureren waar het uit bestaat, hoe het wordt gedaan, voorbeelden

- 3990
- 688
- Ernesto McKenzie
De Lewis -structuur Het is al die weergave van covalente bindingen binnen een molecuul of een ion. Daarin worden deze bindingen en elektronen weergegeven met lange punten of scripts, hoewel de punten meestal overeenkomen met de niet -gedeelde elektronen en de scripts met de covalente bindingen.
Maar wat is een covalente link? Het is het delen van een paar elektronen (of punten) tussen twee atomen van het periodiek systeem. Met deze diagrammen kunt u veel skeletten schetsen voor een bepaalde compound. Welke van hen de juiste is, hangt af van de formele belastingen en de chemische aard van dezelfde atomen.
 2-bromopropan verbinding. Door Ben Million [Public Domain], van Wikimedia Commons.
2-bromopropan verbinding. Door Ben Million [Public Domain], van Wikimedia Commons. In het superieure beeld is er een voorbeeld van wat een Lewis -structuur is. In dit geval is de vertegenwoordigde verbinding 2-broomopropano. De zwarte punten die overeenkomen met de elektronen zijn te zien, zowel degenen die deelnemen aan de links als die niet worden gedeeld (het enige koppel net boven de Br).
Als de punten van punten ":" werden vervangen door een lang script "-", dan zou het koolstofkelet van de 2-broomopropano worden weergegeven als: C-C-C. Waarom in plaats van het "moleculaire frame" getekend, zou het C-H-H-C kunnen zijn? Het antwoord ligt in de elektronische kenmerken van elk atoom.
Omdat waterstof slechts één elektron en een enkele orbitaal beschikbaar heeft om te vullen, alleen een covalente binding. Daarom kunt u nooit twee bindingen vormen (niet verwarren met waterstofbruggen). Aan de andere kant maakt de elektronische configuratie van het koolstofatoom de vorming van vier covalente bindingen mogelijk (en eist).
Om die reden moeten de structuren van Lewis, waarbij C en H consistent moeten zijn en respecteren wat er wordt geregeld door hun elektronische configuraties. Op deze manier, als koolstof meer dan vier bindingen heeft, of waterstof meer dan één, dan kan de schets worden uitgesloten en een nieuwe beginnen in overeenstemming met de realiteit.
Het is hier dat sommige van de belangrijkste redenen of ruggen van deze structuren verschijnen, geïntroduceerd door Gilbert Newton Lewis in hun zoektocht naar moleculaire representaties die trouw zijn aan experimentele gegevens: de moleculaire structuur en formele belastingen.
Alle bestaande verbindingen kunnen worden weergegeven door Lewis -structuren, wat een eerste benadering geeft van hoe het molecuul of ionen zou kunnen zijn.
[TOC]
Wat is de structuur van Lewis?
Het is een representatieve structuur van Valencia -elektronen en covalente bindingen in een molecuul of ion die dient om een idee te hebben van zijn moleculaire structuur.
Deze structuur kan echter geen enkele belangrijke details voorspellen, zoals moleculaire geometrie met betrekking tot een atoom en zijn omgeving (als het vierkant, plat, bipiramidaal, enz.)).
Het zegt ook niets over wat de chemische hybridisatie van zijn atomen is, maar waar de dubbel- of drievoudige bindingen worden geplaatst en als er resonantie is in de structuur.
Met deze informatie kunt u ruzie maken over de reactiviteit van een verbinding, de stabiliteit ervan, hoe en welk mechanisme het molecuul zal volgen tijdens het reageren.
Om deze reden stopt de structuren van Lewis nooit overwogen en zijn ze erg nuttig, omdat ze nieuw chemisch leren kunnen condenseren.
Hoe is het gedaan?
Om een structuur, formule of Lewis -diagram te tekenen of te schetsen, is de chemische formule van de verbinding essentieel. Zonder dat kun je niet eens weten wat de atomen zijn die het goedmaken. Eenmaal daarmee wordt het periodiek systeem gebruikt om te ontdekken welke groepen erbij horen.
Kan u van dienst zijn: viscositeit: voorbeelden, oorzaken, eenheden, typenAls u bijvoorbeeld verbinding hebt14OF2N3 Dan zouden we moeten zoeken naar de groepen waar koolstof, zuurstof en stikstof is. Dit gedaan, ongeacht de verbinding, blijft het aantal valentie -elektronen hetzelfde, dus vroeg of laat onthouden ze.
Aldus behoort koolstof tot de btw -groep, zuurstof tot de via groep en stikstof tot de VA. Het groepsnummer is gelijk aan de hoeveelheid elektronen (punten) van Valencia. Ze hebben allemaal gemeen de neiging om het octet van de Valencia -laag te voltooien.
Wat is de octetregel?
Dit zegt dat er een trend is van atomen om zijn energieniveau te voltooien met acht elektronen om stabiliteit te bereiken. Dit geldt voor alle niet -metalen elementen of die gevonden in blokken S of P van het periodiek systeem.
Niet alle elementen gehoorzamen echter de octetregel. Bepaalde gevallen zijn overgangsmetalen, waarvan de structuren meer gebaseerd zijn op formele belastingen en hun groepsnummer.
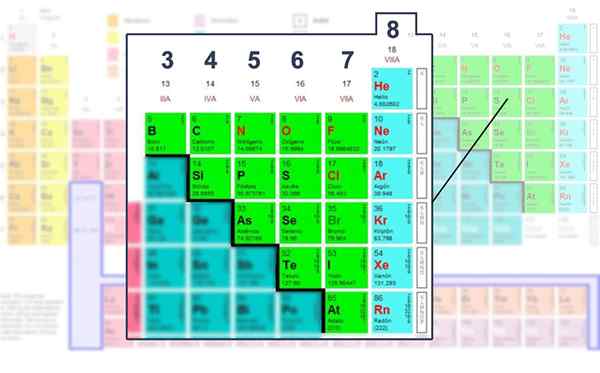 Aantal elektronen van de Valencia -laag van de niet -metalen elementen, die waarin deze kan worden bediend met de Lewis -structuur.
Aantal elektronen van de Valencia -laag van de niet -metalen elementen, die waarin deze kan worden bediend met de Lewis -structuur. De wiskundige formule toepassen
Wetende welke groep de elementen behoren, en daarom is het aantal valentie -elektronen dat beschikbaar is om links te vormen, de volgende formule wordt gemaakt, wat handig is voor het tekenen van Lewis's structuren:
C = n - d
Waar C betekent Gedeelde elektronen, dat wil zeggen degenen die deelnemen aan de covalente obligaties. Aangezien elke link bestaat uit twee elektronen, is C/2 gelijk aan het aantal links (of scripts) dat moet worden getrokken.
N zijn de noodzakelijke elektronen, Degenen die het atoom in zijn Valencia -laag moeten hebben om isolectronisch te zijn voor het edelgas dat in dezelfde periode volgt. Voor alle andere elementen dan H (omdat het twee elektronen vereist om te vergelijken met HE) hebben ze acht elektronen nodig.
D zijn de Beschikbare elektronen, die worden bepaald door de groep of elektronenaantallen van Valencia. Dus, aangezien de CL tot groep VIIA behoort, moet het worden omgeven door zeven zwarte of elektronen, en houd er rekening mee dat een paar nodig is om een link te vormen.
Met de atomen, hun punten en het aantal links c/2, kan een Lewis -structuur vervolgens worden geïmproviseerd. Maar bovendien is het noodzakelijk om een idee te hebben van andere "regels".
Waar de minder elektronegatieve atomen te plaatsen
De minder elektronegatieve atomen in de overgrote meerderheid van de structuren bezetten de centra. Om deze reden, als u een verbinding hebt met atomen van P, O en F, moet de P daarom in het midden van de hypothetische structuur zijn.
Het is ook belangrijk om te benadrukken dat hydrogenen meestal zijn gekoppeld aan zeer elektronegatieve atomen. Als u in een Zn, H en O-verbinding hebt, gaat de H naast de O en niet met de Zn (Zn-O-H en geen H-Zn-O). Er zijn uitzonderingen op deze regel, maar komt meestal voor bij niet -metalen atomen.
Symmetrie en formele belastingen
De natuur heeft een hoge voorkeur voor het zo symmetrisch mogelijk veroorzaken van moleculaire structuren. Dit helpt om wanordelijke structuren te voorkomen, waarbij de atomen zodanig zijn gerangschikt dat ze geen duidelijk patroon gehoorzamen.
Het kan u van dienst zijn: zure-bass-theorieën: Arrhenius, Bronsted-Lowry, LewisBijvoorbeeld voor verbinding C2NAAR3, Waar a een fictief atoom is, zou de meest waarschijnlijke structuur a-c-a-c-a zijn. Let op de symmetrie van hun zijkanten, beide reflecties van de ander.
Formele belastingen spelen ook een belangrijke rol bij het trekken van de structuren van Lewis, vooral voor ionen. Aldus kunnen koppelingen worden toegevoegd of verwijderd zodat de formele belasting van een atoom overeenkomt met de totale weergave die wordt weergegeven. Dit criterium is zeer nuttig voor verbindingen van overgangsmetalen.
Beperkingen in de octetregel
 Aluminium trifluoride representatie, een verbinding die onstabiel is. Beide elementen bestaan uit zes elektronen, die drie covalente bindingen genereert, wanneer ze acht moeten zijn om stabiliteit te bereiken. Bron: Gabriel Bolívar
Aluminium trifluoride representatie, een verbinding die onstabiel is. Beide elementen bestaan uit zes elektronen, die drie covalente bindingen genereert, wanneer ze acht moeten zijn om stabiliteit te bereiken. Bron: Gabriel Bolívar Aan niet aan alle regels wordt voldaan, wat niet noodzakelijkerwijs betekent dat de structuur onjuist is. Typische voorbeelden hiervan worden waargenomen in veel verbindingen waar elementen van groep IIIa (B, AL, GA, in, TL) betrokken zijn. Hier wordt specifiek als aluminium trifluoruro beschouwd (ALF3)).
Als u de hierboven beschreven formule toepast, hebt u:
D = 1 × 3 (een aluminiumatoom) + 7 × 3 (drie fluoratomen) = 24 elektronen
Hier op 3 en 7 zijn de respectieve groepen of aantallen valentie -elektronen die beschikbaar zijn voor aluminium en fluoride. Dan, rekening houdend met de benodigde elektronen N:
N = 8 × 1 (een aluminiumatoom) + 8 × 3 (drie fluoratomen) = 32 elektronen
En daarom zijn de gedeelde elektronen:
C = n - d
C = 32 - 24 = 8 elektronen
C/2 = 4 links
Aangezien aluminium het minst elektronegatieve atoom is, moet het in het midden worden geplaatst en vormt de fluor slechts een link. Gezien dit heb je de Lewis del Alf -structuur3 (bovenste afbeelding). Gedeelde elektronen worden gemarkeerd met groene punten om ze te onderscheiden van de ongekende.
Hoewel de berekeningen voorspellen dat er 4 links zijn die moeten worden gevormd, mist aluminium voldoende elektronen en is er ook geen vierde fluoratoom. Als gevolg hiervan voldoet aluminium niet aan de octetregel en wordt dit feit niet weerspiegeld in de berekeningen.
Lewis structuren voorbeelden
Jodium
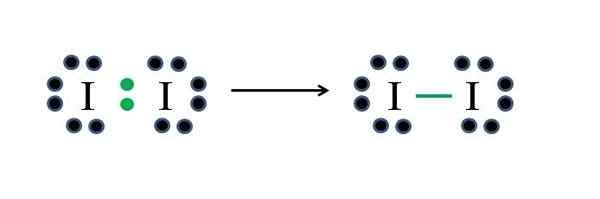 Iodo Non -metalen hebben elk zeven elektronen, dus door elk een van die elektronen te delen, genereren ze een covalente binding die hen stabiliteit geeft. Bron: Gabriel Bolívar
Iodo Non -metalen hebben elk zeven elektronen, dus door elk een van die elektronen te delen, genereren ze een covalente binding die hen stabiliteit geeft. Bron: Gabriel Bolívar Jodium is een halogeen en behoort daarom tot groep VIIA. Het heeft dan zeven elektronen van Valencia, en dit eenvoudige diatomaire molecuul kan worden weergegeven improviseert of de formule toepaste:
D = 2 × 7 (twee jodiumatomen) = 14 elektronen
N = 2 × 8 = 16 elektronen
C = 16 - 14 = 2 elektronen
C/2 = 1 link
Aangezien 14 elektronen 2 deelnemen aan de covalente binding (groene punten en script), blijven er 12 zoals niet gedeeld; En omdat het twee jodiumatomen zijn, moeten er 6 worden verdeeld voor een van hen (hun valentie -elektronen). In dit molecuul is alleen deze structuur mogelijk, waarvan de geometrie lineair is.
Ammoniak
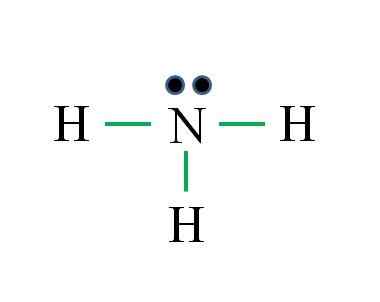 Stikstof heeft 5 elektronen, terwijl alleen waterstof 1. Voldoende om stabiliteit te bereiken wanneer drie covalente bindingen worden vastgesteld, samengesteld uit een elektron van N en een andere van H -bron: Gabriel Bolívar
Stikstof heeft 5 elektronen, terwijl alleen waterstof 1. Voldoende om stabiliteit te bereiken wanneer drie covalente bindingen worden vastgesteld, samengesteld uit een elektron van N en een andere van H -bron: Gabriel Bolívar Wat is de structuur van Lewis voor ammoniakmolecuul? Omdat stikstof van de VA -groep is, heeft het vijf elektronen van Valencia, en vervolgens:
Het kan u van dienst zijn: Laboratoriumthermometer: kenmerken, waarvoor is het, gebruik, voorbeeldenD = 1 × 5 (een stikstofatoom) + 1 × 3 (drie waterstofatomen) = 8 elektronen
N = 8 × 1 + 2 × 3 = 14 elektronen
C = 14 - 8 = 6 elektronen
C/2 = 3 links
Deze keer heeft de formule gelijk met het aantal links (drie groene links). Vanaf de 8 beschikbare elektronen 6 deelnemen aan de bindingen, is er een niet -afgeschermd koppel dat zich boven het stikstofatoom bevindt.
Deze structuur zegt alles wat bekend zou moeten zijn van de ammoniakbasis. Door de kennis van TEV en TRPEV toe te passen, volgt hieruit dat geometrie tetraëdrisch is vervormd door het vrije stikstofkoppel en dat de hybridisatie hiervan daarom SP is3.
C2H6OF
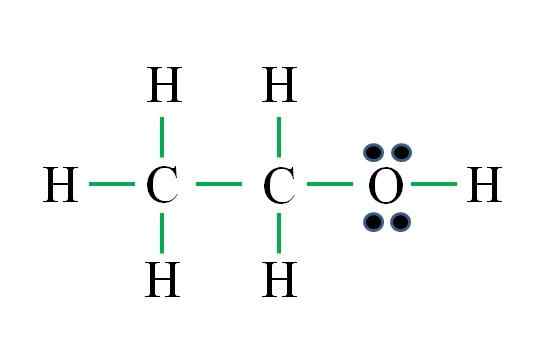 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar De formule komt overeen met een organische verbinding. Voordat de formule wordt toegepast, moet worden herinnerd dat hydrogenen een enkele binding vormen, zuurstof twee, koolstof vier en dat de structuur zo symmetrisch mogelijk moet zijn. Doorgaan naarmate de eerdere voorbeelden zijn:
D = 6 × 1 (zes waterstofatomen) + 6 × 1 (een zuurstofatoom) + 4 × 2 (twee koolstofatomen) = 20 elektronen
N = 6 × 2 (zes waterstofatomen) + 8 × 1 (een zuurstofatoom) + 8 × 2 (twee koolstofatomen) = 36 elektronen
C = 36 - 20 = 16 elektronen
C/2 = 8 links
Het aantal groene scripts komt overeen met de 8 berekende links. De voorgestelde Lewis -structuur is die van ethanol ch3Ch2Oh. Het zou echter ook correct zijn geweest om de structuur van de dimethylether voor te stellen3Och3, die nog symmetrischer is.
Welke van de twee is "meer" correct? Beide zijn evenzeer, omdat de structuren ontstonden als structurele isomeren van dezelfde moleculaire formule C2H6OF.
Permanganaat -ion
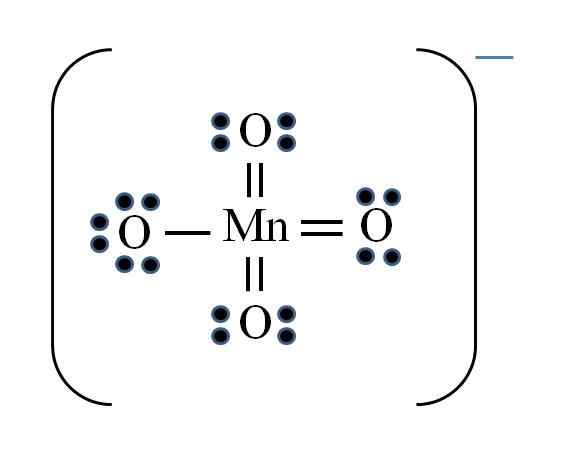 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar De situatie is ingewikkeld wanneer u Lewis -structuren wilt doen voor overgangsmetaalverbindingen. Het mangaan behoort tot de VIIB -groep, ook moet het elektron van de negatieve belasting worden toegevoegd tussen de beschikbare elektronen. De formule toepassen die u hebt:
D = 7 × 1 (een mangaanatoom) + 6 × 4 (vier zuurstofatomen) + 1 elektron per belasting = 32 elektronen
N = 8 × 1 + 8 × 4 = 40 elektronen
C = 40 - 32 = 8 gedeelde elektronen
C/2 = 4 links
Overgangsmetalen kunnen echter meer dan acht elektronen in Valencia hebben. Ook voor het mno -ion4- Vertoont de negatieve belasting, het is noodzakelijk om de formele ladingen van zuurstofatomen te verminderen. Als? Via de dubbele links.
Als alle links van de MNO4- Ze waren eenvoudig, de formele belastingen van de zuurstof zouden gelijk zijn aan -1. Omdat er vier zijn, zou de resulterende belasting -4 zijn voor anion, wat duidelijk niet waar is. Wanneer de dubbele bindingen worden gevormd, wordt gegarandeerd dat een enkele zuurstof een negatieve formele belasting heeft, weerspiegeld in het ion.
In het permanganaat -ion is te zien dat er resonantie is. Dit houdt in dat de enige eenvoudige Mn-O-link wordt gedemocaliseerd tussen de vier atomen van O.
Dicromato ion
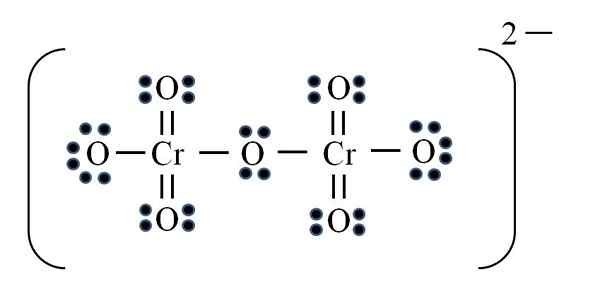 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Ten slotte treedt een soortgelijk geval op met het dicromato -ion (Cr2OF7)). Het chroom hoort bij de VIB -groep, dus het heeft zes elektronen van Valencia. De formule opnieuw toepassen:
D = 6 × 2 (twee chromen atomen) + 6 × 7 (zeven zuurstofatomen) + 2 elektronen door de Divalent -belasting = 56 elektronen
N = 8 × 2 + 8 × 7 = 72 elektronen
C = 72 - 56 = 16 gedeelde elektronen
C/2 = 8 links
Maar er zijn geen 8 links, maar 12. Om dezelfde redenen moeten in het permanganaat -ion twee zuurstof achterblijven met negatieve formele belastingen die gelijk zijn aan -2, de belasting van het dicromato -ion.
Dus, omdat veel dubbele links worden toegevoegd als noodzakelijk. Op deze manier bereik je de Lewis -structuur van de afbeelding voor de CR2OF72-.
Referenties
- Whitten, Davis, Peck & Stanley. Scheikunde. (8e ed.)). Cengage Learning, P 251.
- Lewis -structuren. Genomen uit: chemed.Chem.Purdue.Edu
- Steven A. Hardinger, Afdeling Chemie en Biochemistry, UCLA. (2017). Lewis -structuur. Genomen uit: chem.UCLA.Edu
- Wayne Breslyn. (2012). Lewis -structuren trekken. Uitgebracht van: TerpConnect.Umd.Edu
- Webmaster. (2012). Lewis ("Electron Dot") structuren. Afdeling Chemie, Universiteit van Maine, Orono. Genomen van: chemie.Umeche.Maine.Edu
- Lancaster, Sean. (25 april 2017). Hoe u kunt bepalen hoeveel punten er op de Lewis Dot -structuur van een element zijn. Wetenschap. Hersteld van: wetenschap.com
- « Kenmerken en voorbeelden van particuliere administratie
- Leren theorieën Hoofdkenmerken en auteurs »

