Vloeistofdampbalans

- 2883
- 444
- Miss Herman Russel
Wat is het evenwicht tussen vloeistof en damp?
Hij vloeistofdampbalans Het is een dynamische toestand die een vloeistof vaststelt, of het nu een pure stof of een mengsel is, met de stoom die omringt en met zijn oppervlak werkt. Om te plaatsvinden moet de container worden gesloten, anders zouden de luchtstromen ervoor zorgen dat de vloeistof langzaam verdampt.
Wanneer het systeem wordt gesloten, zal de druk die wordt uitgeoefend door stoomfasemoleculen als de tijd voorbijgaat. Een punt zal komen waar de druk zal stoppen; Dit is de dampdruk van de vloeistof, die een fysieke eigenschap van de materie is, onafhankelijk van de grootte van de container, of het volume vloeistof.
 Wanneer een gasdrank wordt ontdekt, wordt het evenwicht tussen vloeistof-damp gestoord, waardoor de druk buiten en in de fles een onbalans veroorzaakt, en daarmee de bubb. Bron: OpenStax, CC door 4.0, via Wikimedia Commons
Wanneer een gasdrank wordt ontdekt, wordt het evenwicht tussen vloeistof-damp gestoord, waardoor de druk buiten en in de fles een onbalans veroorzaakt, en daarmee de bubb. Bron: OpenStax, CC door 4.0, via Wikimedia Commons Elke vloeistof, puur of gemengd, zal een bijbehorende dampdruk hebben die afhankelijk is van de vluchtigheid van zijn componenten; En daarom van de intermoleculaire krachten die ze bij elkaar houden in de vloeistof en op hun oppervlak.
Deze druk kan worden beschreven door de idealiteit van de oplossingen aan te nemen, of de mengbaarheid van de componenten van een mengsel. Om dit te doen, is het gebruik van binaire diagrammen zeer nuttig, waarin het mogelijk is om de levensvatbaarheid van een scheidingsproces te overwegen.
Het vloeistofvapor-evenwicht is essentieel voor infiniteiten van chemische engineeringprocessen, zoals fractionele destillaties en die gemaakt met waterdamp, waardoor gedestilleerde gedestilleerde in de meest vluchtige componenten worden verkregen. Dit is het geval van ethanol op 95.4% in water, het meest toegankelijke en economische alcoholpercentage op de markt.
Pure substanties
De moleculen van een pure stof zijn niet stil, maar gaan van de ene plaats naar de andere dankzij een intrinsieke kinetische energie. Deze energie kan soms groot genoeg zijn om de intermoleculaire krachten te overwinnen die een molecuul "trekken" van specifiek naar de boezem van de vloeistof. Dan zal het molecuul ontsnappen van het oppervlak van de vloeistof naar de stoomfase.
In de stoomfase zullen de moleculen botsen met de interne wanden van de container, waardoor ze snelheid winnen of verliezen totdat ze herenigen met het oppervlak van de vloeistof, waar ze zodra ze gaan om het conglomeraat van moleculen van de vloeibare fase te integreren.
Kan u van dienst zijn: kobalt: structuur, eigenschappen, toepassingenAldus gaat de tijd totdat, op een bepaalde temperatuur (om 25 ° C te zeggen) het aantal moleculen dat aan het oppervlak ontsnapt, gelijk is aan die die uit stoom binnenkomen. Er wordt daarom gezegd dat een vloeistofdampbalans is vastgesteld in een pure stof.
De dampdruk om de interne wanden van de container te ervaren, evenals het oppervlak van de vloeistof, zal gelijk zijn aan PNAARº, die constant en reproduceerbaar is; Ongeacht hoe groot of klein de container is, noch het volume van de vloeistof om te overwegen.
Mengsels
In vloeibare mengsels zal er ook een component zijn die druk uitoefent op het vloeistofoppervlak en containercontouren. Uw stoomdruk, zoals te verwachten, zal bestaan uit bijdragen van elk van de componenten van het mengsel, om te zeggen, twee stoffen A en B. Deze mengsels kunnen mengbaar zijn, gedeeltelijk mengbaar.
Mengbaar
In een mengbaar mengsel tussen A en B vormen beide stoffen een enkele fase, die op het eerste gezicht eruit ziet als een pure stof. Volgens de wet van Dalton zal de druk van het mengsel of oplossing dus gelijk zijn aan:
Pzon = PNAAR + PB +··· PJe
Zijn PJe Elke andere component die ook aanwezig is in het mengsel. Merk op dat PNAAR≠ PNAARº, dat wil zeggen dat de druk van de stoffen in het mengsel niet hetzelfde is als die van hun hoge zuiverheidstoestanden.
Wanneer de oplossing ideaal is, zijn de verschillen tussen interacties A-A, B-B en A-B duidelijk. Dit kan bijvoorbeeld worden toegepast in een mengsel van ethanol en methanol.
Daarom zullen de dampdruk van de componenten in het mengsel afhankelijk zijn van hun relatieve hoeveelheden in de vloeibare fase, uitgedrukt als molaire fracties xJe. En dit is waar de wet van Rause tussenkomt, die probeert de druk P te relaterenNAAR En PNAARº:
PNAAR = XNAAR PNAARº
Nu de totale druk zijn die gelijk is aan:
Pzon = XNAAR PNAARº + xB PBº +···
De stoomfase zal daarentegen zijn eigen composities hebben, uitgedrukt als yi molaire fracties:
Yi = pJe / Pzon
= XJe PJeº / Pzon
Binair diagram
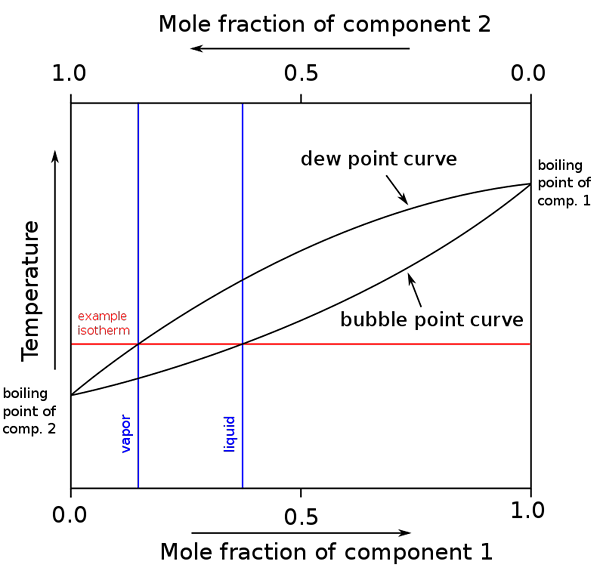 Diagram van kookpunten en molaire samenstellingen voor een binair mengsel. Bron: binary_biling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons
Diagram van kookpunten en molaire samenstellingen voor een binair mengsel. Bron: binary_biling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons Wanneer de molaire fracties van de componenten van een binair mengsel (a + b) grafisch zijn, afhankelijk van de temperatuur of druk, worden binaire diagrammen verkregen (zie hierboven). Deze specifieke vorm, de eenvoudigste, komt overeen met die van ideale oplossingen.
Kan u dienen: Molair volume: concept en formule, berekening en voorbeeldenHet gebied boven de "ovaal" komt overeen met de stoomfase, terwijl het onderstaande gebied overeenkomt met de vloeibare fase van het mengsel. Merk op dat wanneer de molaire fractie van component 1 of 0 (x is1= 0), is de molaire fractie van component 2 of b gelijk aan 1 (x2= 1), en dan is de stoomdruk alleen verschuldigd B. Deze temperatuur wordt het kookpunt van B.
Ondertussen, aan de andere kant (rechts), wanneer x2= 0 maar x1= 1, de dampdruk is alleen. Deze temperatuur wordt die van zijn kookpunt.
De onderste ovale lijn komt overeen met het bellenpunt, dat is wanneer de eerste bubbel verschijnt wanneer het vloeibare mengsel wordt verwarmd (het diagram omhoog gaan). En de bovenste regel komt overeen met het dauwpunt, dat is wanneer de stoomfase afkoelt en de eerste druppel verschijnt (naar beneden in het diagram).
Azeotropos
In veel niet -ideale oplossingen hebben we azeotrops, dit zijn mengsels die verdampen die hun samenstelling constant handhaven; dat wil zeggen, ze verdampen alsof ze een pure compound zijn.
Het is onmogelijk om een azeotrope samenstelling te "breken" door meer destillatiestappen. In plaats daarvan worden andere methoden gebruikt om de zuiverheid van de gewenste component te vergroten.
Het ethanolwatermengsel vormt bijvoorbeeld een azeotrope met een 95-compositie.4 van ethanol. Dit betekent dat het onmogelijk is om door destillaties een ethanol te verkrijgen met een concentratie groter dan 95.4%; Er zal altijd 4 zijn.6% resterende water. Als u absolute ethanol (100%) wilt voorbereiden, zou dit nodig zijn om uitdrogingsmaterialen of andere syntheseroutes te gebruiken.
In een binair diagram kunnen we de aanwezigheid zien van een azeotrope, die de volgende vorm presenteert:
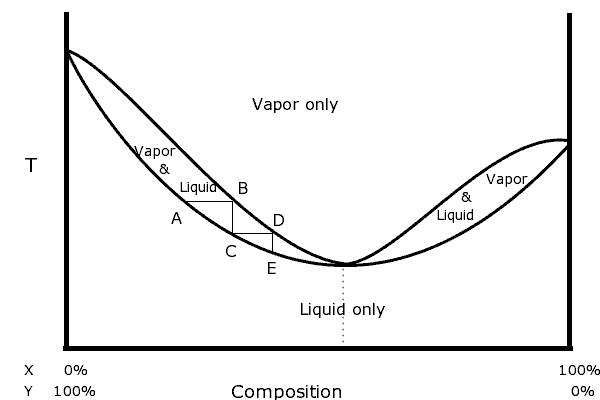 Binair diagram van een mengsel met positieve azeotrope. Bron: Karlhahn in het Engels Wikipedia, Public Domain, via Wikimedia Common
Binair diagram van een mengsel met positieve azeotrope. Bron: Karlhahn in het Engels Wikipedia, Public Domain, via Wikimedia Common Links van het diagram is te zien dat we binnen het "ovaal" een gebied waar we de vloeistofdampbalans hebben, in opeenvolgende stappen (a, b, c, d en e) kunnen destilleren om een steeds rijker te worden mengsel in de meest vluchtige component (x voor dit diagram).
In het azeotropische punt echter, het x- en y- en kookmengsel alsof het een enkele stof is, dus het maakt niet uit hoeveel destillaties worden gemaakt, zowel de vloeistof als de stoom zullen dezelfde compositie hebben.
Kan u van dienst zijn: Moleculaire formule: hoe u het uit kunt krijgen, voorbeelden en oefeningenGedeeltelijk mengbaar
In de gedeeltelijk mengbare mengsels zullen ze worden gevormd, afhankelijk van de temperatuur, twee herkenbare fasen: een rijk aan component A en een andere rijk aan component B. De binaire diagrammen voor deze gevallen zijn veel rigoureuzer en breder, omdat ze regio's omvatten waar stoom samen met de twee fasen samenhangt.
Niet mengbaar
Bij het praten over niet -mengbare mengsels, zal elke component zich gedragen alsof het zich in een staat van hoge zuiverheid bevindt, omdat het nauwelijks interageert met de andere moleculen. Daarom zal de stoomdruk voor deze mengsels gelijk zijn aan:
Pzon = PNAARº + PBº +··· PJeº
Het mengsel kookt bij een temperatuur lager dan die van zuivere componenten, omdat de druk van het niet -mengbare mengsel hoger zal zijn, omdat het gelijk is aan de som van de druk van elke component in zijn zuivere toestand. Meer stoomdruk houdt in dat het vluchtiger is en daarom op een lagere temperatuur kookt.
Toepassingen
Destillaties
In destillaties, vooral op industrieel niveau, is kennis over het evenwicht tussen vloeistof en damping primair. Uit de componenten van het mengsel en de fasediagrammen kan worden berekend hoeveel gerechten nodig zijn bij de constructie van een fractioneringstoren voor de juiste scheiding van genoemde componenten.
Waterdamp destillatie
Waterdamp kan onder destillatie in een mengsel worden gepompt. Wanneer het borrelen van waterdamp in de vloeistof, zal de stoomdruk van het mengsel worden verhoogd, zodat deze bij een lagere temperatuur kookt en de meest vluchtige componenten (zoals essenties) helpt extraheren (zoals essenties).
Drinkvogel
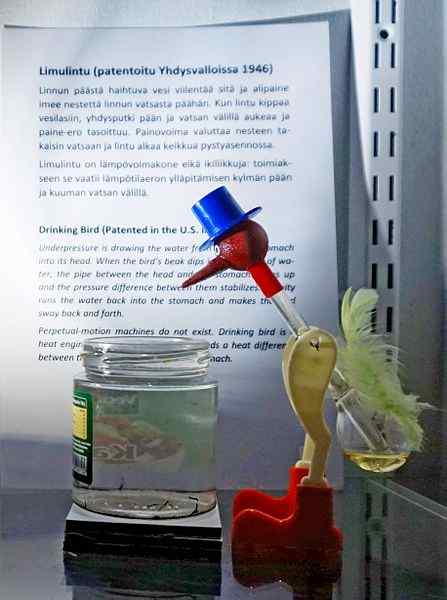 Drinkvogel, een van de meest ingenieuze speelgoed aller tijden. Bron: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons
Drinkvogel, een van de meest ingenieuze speelgoed aller tijden. Bron: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons Hoewel het niet precies een evenwicht voor vloeistofdamp is, is de waarheid dat achter de werking van de drinkvogel verschillende thermodynamische fenomenen verborgen zijn.
Wanneer het hoofd van de vogel nat is, begint het te koelen als het water verdampt. Deze temperatuurdaling veroorzaakt een daling van de druk in de kop van de vogel. Het methyleenchloride, gelegen aan de basis van de vogel, zal proberen de druk in evenwicht te brengen en stroomt omhoog door een glazen buis die de kop met de kop verbindt.
De vloeistof zal naar het hoofd van de vogel stijgen, waardoor het zwaarder wordt en zijn lichaam naar voren kantelt. De vogel "drink water" en stoomdrukken zal in evenwicht zijn. Breng de druk in evenwicht, de vogel van de vogel keert terug naar de verticale positie en de cyclus wordt herhaald terwijl het water van de kop opnieuw verdampt.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Walter J. Moore. (1962). Fysische chemie. (Vierde druk). Longmans.
- Wikipedia. (2020). Damp-vloeibaar evenwicht. Opgehaald uit: in.Wikipedia.borg
- Ed Vitz et al. (5 november 2020). Damp-vloeibaar evenwicht. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Limer Eric. (30 januari 2018). Een absurd gedetailleerde uitleg van het drinkvogelspeelgoed. Hersteld van: PopularMechanics.com
- Universiteit van Alicante. (S.F.)). Onderwerp 4: Berekening van balans-vapor. Evenwichtsdiagrammen. [PDF]. Hersteld van: rua.Ua.is

